
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йод-крахмальная реакция в качественном анализе
|
|
|
|
Краткая характеристика соединений брома и йода
Физические свойства
Br2 при обычной Т – буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора. Насыщенный раствор Br2 в воде называют «бромной водой».
Свободный I2 при обычной Т - черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск. Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Br¯ и I¯. Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl2 = I2 + 2NaCl
2NaBr + Cl2 = Br2 + 2NaCl
2. В лабораторных условиях для получения I2 и Br2 используют, например, следующие реакции:
2NaBr + MnO2 + 2H2SO4 = Br2 ↑ + MnSO4 + Na2SO4 + 2H2O
6HBr(газ) + H2SO4 (конц.) = 3Br2 ↑ + S ↓ + 4H2O
6HI(газ) + H2SO4 (конц.) = 3I2 ↑ + SO2 ↓ + 2H2O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br2 и I2.
Br2 - очень сильный окислитель
Бром – жидкость, в отличие от газообразного Cl2, поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной Т.
Бромная вода – реактив для проведения качественных реакций
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» - тест на присутствие в растворе целого ряда неорганических и органических веществ.
1. Обнаружение в растворах восстановителей
Газообразные и растворенные в воде SO2 и H2S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Br2 + Na2SO3 + H2O = 2HBr + Na2SO4
Br2 + H2S = 2HBr + S↓
Br2 + Na2S + 3H2O = 6HBr + Na2SO3
2. Обнаружение кратных углерод-углеродных связей
Качественная реакция на непредельные органические соединения – обесцвечивание бромной воды:
R-CH=CH-R’ + Br2 → R-CHBr-CHBr-R’
3. Обнаружение фенола и анилина в органических растворах
C6H5OH + Br2 = C6H2Br3OH ↓ + 3HBr
C6H5NH2 + Br2 = C6H2Br3NH2 ↓ + 3HBr
Анионы I¯ очень легко окисляются как сильными, так и слабыми окислителями: 2I¯ -2e → I2
Обнаружить выделяющийся I2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I2. Йод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Реакции с участием I2 в качестве восстановителя
Атомы I2 имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением Eион., благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I20 + 10HN+5O3 = 2HI+5O3 + 10N+4O2 ↑ + 4H2O
I20 + 5H2O2-1 = 2HI+5O3 + 4H2O-2
I20 + 5Cl20 + 6H2O= 2HI+5O3 + 10HCl-1
Бромоводород и йодоводород
HBr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Термическая неустойчивость HBr и HI
Молекулы HBr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
H2 + I2 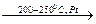 2HI
2HI
Анионы Br¯ и I¯ - более сильные восстановители, чем анионы Cl¯.
HCl получают действием конц. H2SO4 на хлориды(например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H2SO4 до свободных галогенов:
2KBr + 2H2SO4(конц.)  Br2 ↑ + SO2 ↑ + 2H2O + K2SO4
Br2 ↑ + SO2 ↑ + 2H2O + K2SO4
6KI + 4H2SO4(конц.)  3I2 ↑ + S ↓ + 4H2O + 3K2SO4
3I2 ↑ + S ↓ + 4H2O + 3K2SO4
Получение HBr и HI
1. Из бромидов и йодидов
Необходимо вытеснять HBr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой:
KBr + H3PO4(конц.)  HBr ↑ + KH2PO4
HBr ↑ + KH2PO4
KI + H3PO4(конц.)  HI ↑ + KH2PO4
HI ↑ + KH2PO4
2. Гидролиз галогенидов неметаллов
PBr3 + 3H2O  3HBr ↑ + H3PO3
3HBr ↑ + H3PO3
PI3 + 3H2O  3HI ↑ + H3PO3
3HI ↑ + H3PO3
3. Восстановление свободных галогенов в водных растворах
Br2 + SO2 + 2H2O → 2HBr ↑ + H2SO4
I2 + H2S + 2H2O  2HI ↑ + S ↓
2HI ↑ + S ↓
4Br2 + BaS + 4H2O → 8HBr ↑ + BaSO4 ↓
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2241; Нарушение авторских прав?; Мы поможем в написании вашей работы!