
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фтороводород HF
|
|
|
|
Фтор и его соединения
Жавелевая вода
Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы 2-х кислот:  и Cl-Ca-O-Cl
и Cl-Ca-O-Cl
Водный раствор хлорида и гипохлорита калия (KCl + KClO + H2O)
Фтор – самый сильный окислитель из всех простых веществ; непосредственно он не соединяется только с N2, He, Ne, Ar, а также при обычных условиях – с O2.
Химические свойства
1. Взаимодействие с металлами
Me +F2 → Me+xFx1- (фториды)
а) со щел. Ме. – со взрывом
б) с большинством Ме. – воспламенение
в) с малоактивными – при нагревании(при высокой Т даже Pt горит в атмосфере F2)
2. Взаимодействие с неметаллами
S + 3F2= SF6 (реакция протекает даже при охлаждении жидким N2)
2P + 5F2 = 2PF5 (реакция протекает даже при охлаждении жидким N2)
H2 + F2= 2HF (даже в темноте – со взрывом)
3. Взаимодействие с водой
Фтор нельзя растворить в воде и получить «фторную воду», так как он активно разлагает воду. Среди продуктов реакции обнаруживаются: фториды кислорода OF2, O2F2; пероксид водорода H2O2; кислород, озон, фтороводород.
2F2 + H2O = OF2 + 2HF
2F2 + 2H2O = O2 + 4HF
4. Взаимодействие с SiO2
Кварц загорается в атмосфере F2
2F2 + SiO2 = SiF4 + O2
Физические свойства: cамое прочное вещество среди HHal, образовано сильнополярными молекулами.По сравнению с другими HHal имеет аномально высокие Tпл. и Tкип. Причина – объединение молекул в прочные ассоциаты (HF)n водородными связями: …H+ - F- - …H+ - F- …
Фтороводород – бесцв. легкоподвижная и легкоиспаряющаяся жидкость с резким, удушающим запахом.
Водный р-р HF – плавиковая кислота (фтороводородная к-та)
Фтороводород обладает неограниченной растворимостью в воде; образующийся раствор имеет свойства слабой кислоты. Название «плавиковая кислота» получила из-за способности растворять кварц, стекло и все силикаты.
Химические свойства
1. Взаимодействие с металлами
Проявляет все свойства, характерные для класса кислот. Некоторые металлы не растворяются в плавиковой кислоте, так как образующиеся малорастворимые фториды образуют на поверхности металла защитную пленку.
Очень эффективным растворителем металлов является смесь HF и HNO3, в которой HNO3 играет роль окислителя, а HF - комплексообразователя:
8HF + 2 HNO3 + W = H2[WF2] + 2NO↑ + 4H2O
2. Взаимодействие с Si, SiO2 - специфическое свойство HF
Нерастворимый в воде и в кислотах кремний реагирует с HF и HF+HNO3
Si + 4HF = SiF4 + 2H2 ↑
3Si + 12HF + 4HNO3 = 3SiF4 + 4 NO ↑ + 8H2O
Оксид кремния SiO2 не реагирует с водой и всеми кислотами, кроме плавиковой, в которой он медленно растворяется:
SiO2 + 6HF = H2SiF6 + 2H2O
Получение HF
Синтез из простых веществ: H2 + F2 = 2HF
Действие конц. H2SO4 на фториды металлов: CaF2 + H2SO4 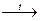 CaSO4 + 2HF ↑
CaSO4 + 2HF ↑
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2463; Нарушение авторских прав?; Мы поможем в написании вашей работы!