
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хлороводород и соляная кислота
|
|
|
|
Газообразный хлороводород: физические и химические свойства
HCl – хлорид водорода. Бесцветный газ с резким запахом. Безводный HCl и в газообразном, и в жидком состояниях неэлектропроводен. Химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный хлороводород реагирует с металлами, причем такими малоактивными, как Cu и Ag.
Восстановительные свойства хлорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при обычной Т, а также при высокой Т в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Cl2 + 2HF
4HCl + O2 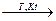 2Cl2 + 2H2O
2Cl2 + 2H2O
Газообразный HCl широко используется в органическом синтезе.
Водный раствор HCl – сильная кислота
(хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при обычной Т в 1 л Н2О растворяется около 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37%. Такой раствор имеет очень резкий, удушающий запах. Молекулы HCl в воде практически полностью распадаются на ионы, т.е. водный раствор хлороводорода является сильной кислотой.
Химические свойства
Взаимодействие:
1. с металлами (до Н):
2HCl + Zn = ZnCl2 + H2↑
2. с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
3. с основаниями и амфотерными гидроксидами:
2HCl + Ca(OH)2 = CaCl2 + 2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
4. с солями более слабых кислот:
2HCl + CaCO3 = CaCl2 + CO2↑ + H2O
HCl + C6H5ONa = C6H5OH + NaCl
5. с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями (Анион Cl- окисляется до свободного галогена: 2Cl- - 2e → Cl2↑).
Особое значение имеет ОВР между соляной и азотной кислотами:
3HCl + HNO3 = Cl2↑ + NOCl + 2H2O
(“царская водка”)
NOCl = NO + Cl(атомарн.)
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1360; Нарушение авторских прав?; Мы поможем в написании вашей работы!