
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И указать реакцию среды их водных растворов
|
|
|
|
УРОВЕНЬ А
ГИДРОЛИЗ СОЛЕЙ
1. Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
а) сульфата хрома (III) (Cr2(SO4)3),
б) сульфида натрия (Na2S)

| РЕШЕНИЕ: а) Cr2(SO4)3 1. Под формулой соли написать формулы основания и кислоты, которыми образована соль, и подчеркнуть общий ион в формуле соли и слабого электролита. |
2.

 Cr2 (SO4)3 + 2Н2О <=> 2CrOHSO4 + H2SO4
Cr2 (SO4)3 + 2Н2О <=> 2CrOHSO4 + H2SO4
|
|
слаб. сильн.


 Cr 3+ + H+ OH - <=> +, pH<7, среда
Cr 3+ + H+ OH - <=> +, pH<7, среда
кислая

2. Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды.
3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы, образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты в молекулярном уравнении.
б) Na2S
Используя последовательность написания процесса гидролиза, изложенное в а) составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли Na2S.
Na2 S + H2O <=> NaHS + NaOH

 NaOH + H2 S
NaOH + H2 S
|
|

 S2- + H +OH- <=> +, pH > 7, среда
S2- + H +OH- <=> +, pH > 7, среда


 щелочная
щелочная
2. Написать ионно-молекулярное и молекулярное уравнения гидролиза хлорида алюминия (AlCl3). Как влияет на равновесие гидролиза прибавление к раствору следующих веществ:
а) хлороводородной кислоты (HCl);
б) гидроксида калия (KOH);
в) нитрата натрия (NaNO3)?
РЕШЕНИЕ
 Al Cl3 + HOH <=> AlOHCl2 + HCl
Al Cl3 + HOH <=> AlOHCl2 + HCl
 Al (OH)3 + HCl
Al (OH)3 + HCl
|
|

 Al3+ + H+ OH - <=> +
Al3+ + H+ OH - <=> +
 |
Как видно из сокращенного ионно-молекулярного уравнения, при гидролизе образуются катионы Н+, обуславливающие кислую среду раствора (рН<7).
Реакция гидролиза – процесс обратимый, поэтому равновесие гидролиза соли может смещаться при введении в раствор некоторых веществ (согласно правилу смещения равновесия по принципу Ле Шателье).
а) Если к раствору AlCl3 добавить хлороводородную кислоту HCl, то в результате её диссоциации (HCl = H+ + Cl-) в растворе увеличится концентрация ионов H+, вследствие чего равновесие реакции гидролиза AlCl3 сместится в левую сторону (образование исходных веществ), т.е. гидролиз AlCl3 ослабевает.
|
 ←
←
Al3+ + HOH <=> AlOH2+ +
HCl = Cl- +
б) Если же к раствору AlCl3 добавить щелочь (КОН), то в результате ее диссоциации (КОН = К+ + ОН-) в растворе появляются ионы ОН-, которые с ионами Н+, полученными в реакции гидролиза, образуют молекулу слабого электролита (H2O), что приведет к уменьшению концентрации ионов Н+ и смещению равновесия реакции гидролиза в правую сторону, т.е. гидролиз AlCl3 усилится.
|
 →
→
Al3+ + HOH <=> AlOH2+ + → Н2О
КОН = К+ +
в) Нитрат натрия – сильный электролит, который не имеет общих ионов ни с AlCl3, ни с продуктами его гидролиза, и не связывает их в слабодиссоциирующие соединения, т.е. прибавление NaNO3 на равновесие гидролиза не влияет.
 Al3+ + HOH <=> AlOH2+ + H+
Al3+ + HOH <=> AlOH2+ + H+
NaNO3 = Na+ + NO3-
3. Что произойдет при сливании растворов хлорида железа (II) (FeCl2) и карбоната натрия (Na2CO3)? Написать уравнения реакций в ионно-молекулярной и молекулярной формах.

| РЕШЕНИЕ:
До сливания в растворе каждой соли протекает ее гидролиз по I ступени (гидролизу подвергаются ионы Fe2+ и CO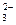 ):
Fe Cl2
Fe (OH)2 + HCl слаб. сильн.
Na2 CO3
NaOH + H2 CO 3
сильн. слаб. ):
Fe Cl2
Fe (OH)2 + HCl слаб. сильн.
Na2 CO3
NaOH + H2 CO 3
сильн. слаб.
|
|
Fe2+ +HOH <=> FeOH+ + → Н2О
CO32-+ HOH <=> HCO3-+
После сливания растворов продукт гидролиза первой соли (Н+) взаимодействует с продукт ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
|
FeOH+ + HOH <=> Fe(OH)2↓ + + → Н2О
HCO3- + HOH <=> H2CO3 +
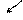

CO2↑ H2O
Сокращенное ионно-молекулярное уравнение гидролиза двух солей:
Fe2+ + CO32- + H2O = Fe(OH)2↓ + CO2↑.
Молекулярное уравнение совместного гидролиза:
FeCl2 + Na2CO3 + H2O = Fe(OH)2↓ + CO2↑ + 2NaCl
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1340; Нарушение авторских прав?; Мы поможем в написании вашей работы!