
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка
|
|
|
|
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10-3М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

| РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
 = - 0,76 В,
= - 0,76 В, 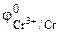 = - 0,74В.
= - 0,74В.
Хлорид цинка диссоциирует по уравнению:
ZnCl2 = Zn2+ + 2Сl-.
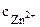 =
= 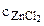 ∙α∙
∙α∙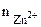 = 1∙1∙1 = 1 моль/л,
= 1∙1∙1 = 1 моль/л,
α = 1 (ZnCl2 – сильный электролит), 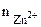 = 1, поскольку условия стандартные
= 1, поскольку условия стандартные  = -0,76В.
= -0,76В.
Хлорид хрома (III) диссоциирует по уравнению:
CrCl3 = Cr3+ + 3Сl-
 =
=  ∙α∙
∙α∙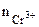 = 10-3∙1∙1 = 10-3 моль/л,
= 10-3∙1∙1 = 10-3 моль/л,
α = 1 (CrCl3 – сильный электролит), 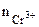 = 1, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
= 1, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
 =
= 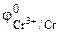 +
+  = -0,74 +
= -0,74 + lg10-3= -0,80В
lg10-3= -0,80В
Так как  <
< , то в ГЭ анодом будет являться хром, катодом – цинк.
, то в ГЭ анодом будет являться хром, катодом – цинк.
Составляем схему ГЭ:
А (-) Cr │ CrCl3 ││ ZnCl2 │ Zn (+) K
А (-) Cr │ Cr3+ ││ Zn2+ │ Zn (+) K
Составляем уравнения электродных процессов и суммарной токообразующей реакции:

 НОК ДМ
НОК ДМ
На A(-)Cr – 3ē = Cr3+ 2
На К(+)Zn2+ + 2ē = Zn 3

2Cr + 3Zn2+ = 2Cr3+ + 3Zn - суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn - суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
 =
=  -
- 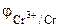 = -0,76-(-0,80)= 0,04В
= -0,76-(-0,80)= 0,04В
Ответ: ε = 0,04В.
2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni2+ = Fe2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG0(298К, Men+) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
∆fG0 (298 К, Ni2+) = - 64,4 кДж/моль;
∆fG0 (298 К, Fe2+) = - 84,94 кДж/моль.
Дано:
ΔfG0(298K, Ni2+) = -64,4 кДж/моль
ΔfG0(298K, Fe2+) = -84,94 кДж/моль
Т = 298 К
 ε0 -? Кс -?
ε0 -? Кс -?
| РЕШЕНИЕ: На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов: |
НОК ДМ

 На A(-)Fe – 2ē = Fe2+ 1 - окисление
На A(-)Fe – 2ē = Fe2+ 1 - окисление
На К(+)Ni2+ + 2ē = Ni 1 - восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe2+ ║ Ni2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
∆rG0 (298 К) = - z∙F∙ε0,
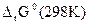 = ∆fG0 (298 К, Fe2+) - ∆fG0 (298 К, Ni2+) =
= ∆fG0 (298 К, Fe2+) - ∆fG0 (298 К, Ni2+) =
= -84,94-(-64,4) = -20,54 кДж,
ε0 = 
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
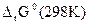 = - 2,303∙R∙T∙lgKc;
= - 2,303∙R∙T∙lgKc;
lgKс = 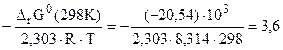
Kс = 103,6 = 3981
Ответ: ε0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10-3 г. Плотность железа равна 7,9 г/см3.
РЕШЕНИЕ:
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:
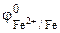 = - 0,44В,
= - 0,44В, 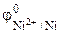 = - 0,26В.
= - 0,26В.
Так как 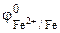 <
<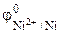 , то анодом коррозионного ГЭ будет являться железо, катодом – никель.
, то анодом коррозионного ГЭ будет являться железо, катодом – никель.
Составим схему коррозионного ГЭ:
А (-) Fe │ HCl │ Ni (+) K
или
А (-) Fe │ H+ │ Ni (+) K
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe2+
 На К 2Н+ + 2ē = Н2
На К 2Н+ + 2ē = Н2
Fe + 2H+ = Fe2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.
а)

| Рассчитываем объемный показатель коррозии KV по формуле:
KV =  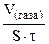 , см3/м2∙час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3]. , см3/м2∙час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3].
|
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 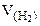 .
.
Тогда, KV =  =
= 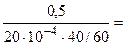 375 см3/м2∙час.
375 см3/м2∙час.
10-4 – коэффициент пересчета, см2 в м2.
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 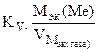 , г/м2∙час.
, г/м2∙час.
В процессе коррозии разрушению подвергается железо и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Fe) = 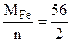 =28 г/моль,
=28 г/моль,
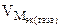
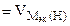 = 11200 см3/моль.
= 11200 см3/моль.
Km =  = 0,94 г/м2∙час.
= 0,94 г/м2∙час.
Ответ: KV = 375 см3/м2∙час, Km = 0,94 г/м2∙час.
б)

| Рассчитываем весовой показатель коррозии Km по формуле:
Km =  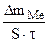 , г/м2∙час.
Коррозии подвергается железо. Тогда потеря массы металла , г/м2∙час.
Коррозии подвергается железо. Тогда потеря массы металла 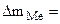  . .
|
При расчете Km принимаем: 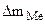 - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час].
Тогда: Km = 
 =
= 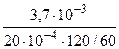 = 0,925 г/м2∙час.
= 0,925 г/м2∙час.
Рассчитываем глубинный показатель коррозии по формуле:
П =  =
=  мм/год.
мм/год.
Ответ: Km = 0,925 г/м2∙час, П = 1,03 мм/год.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2532; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 ε -?
ε -?