
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение и химические свойства металлов
|
|
|
|
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
УРОВЕНЬ В
Дано:
Электролит:
K2SO4
τ = 4 ч
Т = 298 К
I = 2 A
Р = 99 кПа
Анод инертный
 1. Схема электролиза-?
2.
1. Схема электролиза-?
2.  (катод) -?
3. (катод) -?
3. 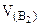 (анод) -? (анод) -?
| РЕШЕНИЕ
K2SO4 = 2K+ +  Схема электролиза:
K(-) A(+) (инертный)
K+
Схема электролиза:
K(-) A(+) (инертный)
K+ 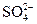 2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
|
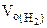 =
=  = 3,34 л.
= 3,34 л.
где  = 11,2 л/моль.
= 11,2 л/моль.
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
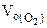 =
=  = 1,67 л,
= 1,67 л,
где  = 5,6 л/моль, т.е.
= 5,6 л/моль, т.е. 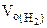 = 2
= 2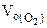
Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:
 ,
,
откуда:  =
=  = 3,73 л
= 3,73 л
Объем кислорода при заданных условиях:
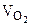 = 1/2
= 1/2 = 1,865 л.
= 1,865 л.
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длится осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см3.
  Дано:
Электролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3 Дано:
Электролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3
 Анод медный
Схема электролиза-? Анод медный
Схема электролиза-?
 Время электролиза, τ -? Время электролиза, τ -?
|  РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ= РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ=  ; mCu(факт) =mCu(теор)·ВТ ; mCu(факт) =mCu(теор)·ВТ
|
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) =  .
.
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см2, h – см, ρ – г/см3.
S∙h∙ρCu =  ,
,
откуда
τ = 1,43 часа,
1,43 часа,
где Mэк(Cu) =  = 32 г/моль
= 32 г/моль
F = 26,8 – А∙ч/моль,
10-1 – коэффициент пересчета мм в см.
Ответ: 1,43 часа.
3. Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
  Дано:
Электролит: AgNO3
I = 4 A Дано:
Электролит: AgNO3
I = 4 A
 = 75 см3
τ = 25 мин
Анод инертный = 75 см3
τ = 25 мин
Анод инертный
 Схема электролиза-?
Схема электролиза-?
 -? -?
|  РЕШЕНИЕ
AgNO3 = Ag+ + РЕШЕНИЕ
AgNO3 = Ag+ +  Схема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag
Схема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag  H2O 2H2O - 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
H2O 2H2O - 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
|
 Молярная концентрация эквивалента раствора AgNO3:
Молярная концентрация эквивалента раствора AgNO3:
 =
= 
По закону эквивалентов: nэк(AgNO3) = nэк(Ag),
nэк(Ag) =  ,
,
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg =  , откуда
, откуда
 =
= = nэк(Ag) = nэк(AgNO3)
= nэк(Ag) = nэк(AgNO3)
Молярная концентрация эквивалента раствора AgNO3:
 =
=  = 0,83 моль/л.
= 0,83 моль/л.
где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10-3 – коэффициент пересчета см3 в л.
Ответ:  = 0,83 моль/л.
= 0,83 моль/л.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 667; Нарушение авторских прав?; Мы поможем в написании вашей работы!