
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычислить массовую долю оксида цинка в смеси с цинком, если при взаимодействии 7,27 г смеси с водным раствором щелочи выделилось 1,12 л водорода (н.у.)
|
|
|
|
УРОВЕНЬ А
1. Используя справочные данные по ΔfH0(298K) и S0(298K), определить температурную границу возможного технического использования карботермического процесса: PbO(к) + C(к) < = > Pb(к) + CO(г)
Записать выражение для константы равновесия Кр
| Дано: Уравнение реакции | РЕШЕНИЕ: Приведенный процесс будет возможен, когда равновесное давление оксида углерода (II) будет равно наружному давлению или превышать его, т.е. РСО = 1 |
| Т -? |
Поскольку КР = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
- 2,303RT lgKP = ΔrH0(298K) – ΔrS0(298K)
Так как lgKP = lg1 = 0, то 0 = ΔrН0(298K)1000 – ТΔrS0(298K)
Откуда 
где 1000 – коэффициент перевода кДж в Дж
ΔrH0(298K) и ΔrS0(298K) определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
PbO(к) + C(к) < = > Pb(к) + CO(г) (12.1)
ΔfH0(298K) -219,3 0 0 -110,5
кДж/моль
S0(298K) 66,1 5,7 64,9 197,5
Дж/мольК
ΔrH0(298K) = -110,5 – (-219,3) = 108,8 кДж
ΔrS0(298K) = 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К
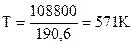
Ответ: процесс возможен при нагревании начиная с Т = 571К
Дано:
Смесь Zn и ZnO
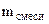 = 7,27 г
Vо ( = 7,27 г
Vо (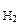 ) = 1,12 л ) = 1,12 л

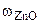 -? -?
| РЕШЕНИЕ:
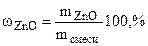
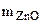 = = 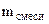 - - 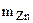 ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2)
Zn о+2
ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2)
Zn о+2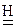 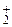  +2NaOH=Na2[ Zn +2(OH)4] + +2NaOH=Na2[ Zn +2(OH)4] + 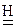 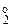 (12.3) (12.3)
|

 НОК ДМ
НОК ДМ
Znо – 2e = Zn+2 1
H+ + e = Hо 2
 |
Zn + 2H+ = Zn+2 + 2Hо
Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции (12.3):
Составляем пропорцию:
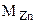 вытеснит 22,4 л Н2
вытеснит 22,4 л Н2
 65,4 г Zn 22,4 л Н2
65,4 г Zn 22,4 л Н2

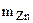 1,12 л Н2
1,12 л Н2
где 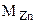 = 65,4 г/моль
= 65,4 г/моль
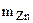 =
= 
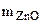 =
= 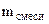 -
- 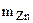 = 7,27 – 3,27 = 4 г
= 7,27 – 3,27 = 4 г
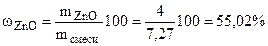
Ответ:  .
.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 4932; Нарушение авторских прав?; Мы поможем в написании вашей работы!