
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. Определить концентрацию ионов Ag+ в 0,0IM растворе K[Ag(CN)2], содержащем кроме того 0,05 моль/л NaCN
1. Определить концентрацию ионов Ag+ в 0,0IM растворе K[Ag(CN)2], содержащем кроме того 0,05 моль/л NaCN. Константа устойчивости комплексного иона [Ag(CN)2]- равна 1·1021.
Дано:
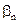 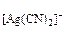 = 1·1021 = 1·1021
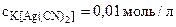
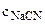 = 0,05 моль/л = 0,05 моль/л
 [Ag+] -?
[Ag+] -?
| РЕШЕНИЕ Равновесную концентрацию ионов Ag+ можно определить из выражения константы устойчи- вости комплексного иона: |
Ag+ + 2CN- <=> [Ag(CN)2]- (13.1)
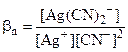 = 1·1021 (13.2)
= 1·1021 (13.2)
Введение в раствор комплексной соли сильного электролита NaCN, который диссоциирует по уравнению:
NaCN = Na+ + CN- (13.3)
приводит, согласно принципа Ле-Шателье, к смещению равновесия (13.1) в сторону образования комплексного иона и устанавливается новое равновесие. Значение βn при этом не изменяется.
Обозначим равновесную концентрацию ионов серебра в новых условиях через х:
[Ag+] = х моль/л
Общая равновесная концентрация [CN-] равна сумме концентраций CN-, образовавшихся при диссоциации NaCN и [Ag(CN)2]-:
[CN-] =  +
+ 
из [Ag(CN)2]- из NaCN
 = 2х моль/л;
= 2х моль/л;
из [Ag(CN)2]-
 =
= 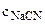 ·α·
·α·
из NaCN
так как NaCN сильный электролит, α=1,  =1, то
=1, то  =0,05 моль/л. Тогда:
=0,05 моль/л. Тогда:
[CN-] = (2х + 0,05) моль/л.
Концентрацию иона [Ag(CN)2]- определяем из уравнения первичной диссоциации:
K[Ag(CN)2] = К+ + [Ag(CN)2]- (13.4)
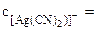
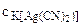 ·α·n; α=1 так как первичная диссоциация протекает по типу диссоциации сильных электролитов,
·α·n; α=1 так как первичная диссоциация протекает по типу диссоциации сильных электролитов,
n = 1:
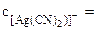 0,01 моль/л.
0,01 моль/л.
Тогда равновесная концентрация иона [Ag(CN)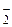 ] равна:
] равна:
[Ag(CN)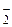 ] = (0,01-х) моль/л.
] = (0,01-х) моль/л.
Подставляем полученные данные в выражение (13.2)
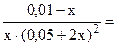 1·1021
1·1021
Так как х << 0,01, то значением х ввиду его малости в выражении (0,01 - х) и значением 2х в выражении (0,05+2х) можно пренебречь и данное выражение записать в виде:
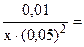 1·1021, откуда х =
1·1021, откуда х = 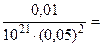 4·10-21 моль/л
4·10-21 моль/л
[Ag+] = 4·10-21 моль/л.
Ответ: [Ag+] = 4·10-21 моль/л.
2. Выпадает ли осадок NiS, если к 1М раствору [Ni(NH3)6]Cl2 прилить равный объем 0,005М раствора K2S.
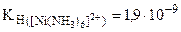 (табл.)
(табл.) 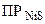 = 1·10-9(табл.)
= 1·10-9(табл.)
Дано:
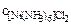 = 1 моль/л = 1 моль/л
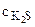 =0,005 моль/л
ПРNiS = 1·10-9
К Н =0,005 моль/л
ПРNiS = 1·10-9
К Н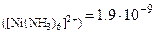
 Выпадает ли осадок NiS
Выпадает ли осадок NiS
| РЕШЕНИЕ:
Осадок NiS образуется, если
 · ·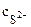 > ПРNiS (табл.)
Концентрацию иона Ni2+ определяем по концентрации раствора [Ni(NH3)6]Cl2.
Комплексная соль [Ni(NH3)6]Cl2 диссоциирует по уравнению: > ПРNiS (табл.)
Концентрацию иона Ni2+ определяем по концентрации раствора [Ni(NH3)6]Cl2.
Комплексная соль [Ni(NH3)6]Cl2 диссоциирует по уравнению:
|
[Ni(NH3)6]Cl2 = [Ni(NH3)6]2+ + 2Cl – (первичная диссоциация) (13.5)
Из уравнения (13.5) определяем концентрацию комплексного иона:
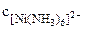 =
= 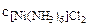 ·α·n = 1 моль/л.
·α·n = 1 моль/л.
где α = 1; n = 1
Комплексный ион в свою очередь диссоциирует равновесно:
[Ni(NH3)6]2+ <=> Ni2+ + 6NH3 (вторичная диссоциация) (13.6)
Обозначим равновесную концентрацию ионов никеля через х:
[Ni2+] = х моль/л.
Тогда, согласно уравнения (13.6):
[NH3] = 6х моль/л;
[Ni(NH3)62+] = (1-х) моль/л.
Константа нестойкости комплексного иона из уравнения (13.6) равна:
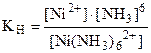 (13.7)
(13.7)
Подставим полученные данные в выражение (13.7):
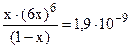
Так как х<<1, то значением х ввиду его малости в выражении (1-х) можно пренебречь и данное выражение записать в виде:
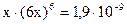 , откуда х =
, откуда х =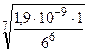 = 0,243 моль/л.
= 0,243 моль/л.
[Ni2+] = с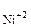 = 0,243 моль/л.
= 0,243 моль/л.
Из уравнения диссоциации:
K2S = 2K+ + S2-
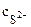 = с
= с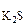 ·α·
·α·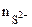 = 0,005·1·1 = 5·10-3 моль/л
= 0,005·1·1 = 5·10-3 моль/л
где α·= 1; 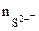 = 1.
= 1.
При сливании равных объемов растворов солей K2S и [Ni(NH3)6]Cl2 концентрация всех ионов уменьшается в 2 раза и составит:
с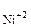 = 1/2·0,243 = 0,1215 моль/л.
= 1/2·0,243 = 0,1215 моль/л.
с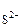 = 1/2·5·10-3 = 0,0025 моль/л
= 1/2·5·10-3 = 0,0025 моль/л
Произведение с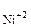 ·с
·с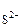 = 0,1215·0,0025 = 3·10-4, т.к.
= 0,1215·0,0025 = 3·10-4, т.к.
3·10-4 > 1·10-9 (табл. величина ПРNiS) то осадок NiS выпадает.
Ответ: осадок NiS выпадает.
3. К раствору, содержащему 0,2675 г комплексной соли
CoCl3·6NH3 добавили в избытке раствор AgNO3. Масса осажденного AgCl составила 0,4305 г. Определить координационную формулу соли, назвать её и написать уравнения диссоциации в водном растворе.
Дано:
 =0,2675 г =0,2675 г
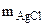 = 0,4305 г = 0,4305 г
 Формула комплексной соли -?
Формула комплексной соли -?
| РЕШЕНИЕ: Для написания координационных формул необходимо знать состав внутренней и внешней сферы этой соли. Из раствора комплексной соли можно осадить в виде AgCl↓, только ионы Cl-, входящие во внешнюю сферу. |
Таким образом, в состав осадка (AgCl) входят Cl-, находящиеся только во внешней сфере комплексной соли.
Обозначим число ионов Cl- во внешней сфере комплексной соли – n.
Тогда число ионов Cl- во внутренней сфере комплексной
соли – (3- n).
При добавлении к раствору комплексной соли раствора AgNO3протекает реакция:
[Co(NH3)6Cl(3-n)]Cln + nAgNO3 = nAgCl↓ + [Co(NH3)6Cl(3-n)](NO3)n
Поскольку в молекуле AgCl на 1 ион Ag+ приходится 1 ион Cl-, то из одной молекулы комплексной соли образуется n молекул AgCl.
[Co(NH3)6Cl(3-n)]Cln - nAgCl
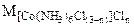 - nM
- nM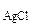
267,5г - n143,5 г
0,2675г - 0,4305 г
n = 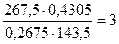
Следовательно все три иона Cl- находятся во внешней сфере. Формула комплексной соли [Co(NH3)6]Cl3.
Первичная диссоциация соли:
[Co(NH3)6]Cl3 = [Co(NH3)6]3+ + 3Cl-
Вторичная диссоциация:
[Co(NH3)6]3+ <=> Co3+ + 6NH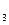
[Co(NH3)6]Cl3 – хлорид гексаaмминкобальта (III)
Ответ: [Co(NH3)6]Cl3.
|
|
Дата добавления: 2014-10-15; Просмотров: 2533; Нарушение авторских прав?; Мы поможем в написании вашей работы!