
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определить, образуется ли осадок хлорида свинца (II), если к 0,05 М раствору нитрата свинца (II) добавить равный объем 0,02 М раствора хлороводородной кислоты
|
|
|
|
Определить объем 1 н раствора гидроксида натрия, который расходуется на взаимодействие с 4,5 г хлорида алюминия при образовании тетрагидроксоалюмината натрия.
УРОВЕНЬ В
Уравнять реакцию методом электронного баланса.
Указать окислитель и восстановитель:
PbO2 + HCl → PbCl2 + Cl2 + H2O
| Дано: Уравнение реакции |
| Уравнять реакцию и указать окислитель и восстановитель |
РЕШЕНИЕ:
Pb+4O2+ HCl-1 → Pb+2Cl2 + Cl20 + H2O
НОК ДМ

 восст-ль Cl-1 - 1e = Cl0 2
восст-ль Cl-1 - 1e = Cl0 2
 окисл-ль Pb+4 + 2e = Pb+2 1
окисл-ль Pb+4 + 2e = Pb+2 1
2Cl-1 + Pb+4 = Cl20 + Pb+2
Переносим найденные коэффициенты в молекулярное уравнение, окончательно уравниваем его, учитывая при этом количество ионов Cl-, необходимое для получения PbCl2.
PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O
Дано:
 = 4,5 г
сэк(NaOH) = 1 моль/л = 4,5 г
сэк(NaOH) = 1 моль/л
|
 -? -?
|
РЕШЕНИЕ:
Тетрагидроксоалюминат натрия образуется при протекании следующих последовательных реакций:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3
 Al(OH)3 + NaOH =Na[Al(OH)4]
Al(OH)3 + NaOH =Na[Al(OH)4]
4NaOH + AlCl3 = 3NaCl + Na[Al(OH)4] (суммарное уравнение)
4 MNaOH - M
mNaOH - m
m =
= 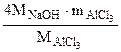 =
= 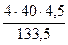 = 5,39 г
= 5,39 г
сэк(NaOH) = 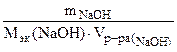 , откуда
, откуда
 =
=
= = 0,135 л = 135 см3
= 0,135 л = 135 см3
Ответ:  = 135 cм3
= 135 cм3
Дано:
с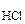 = 0,02 M
с = 0,02 M
с = 0,05 M
V = 0,05 M
V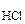 = V = V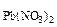
|
| Образуется ли осадок-? |
РЕШЕНИЕ:
При сливании растворов протекает следующая реакция:
Pb(NO3)2 + 2HCl= PbCl2 + 2HNO3
+ 2HNO3
Осадок PbCl2 образуется только в случае, если
с ·с
·с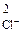 > ПР
> ПР = 2·10
= 2·10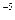 (табл.)
(табл.)
С учетом увеличения объема раствора при сливании в 2 раза:
с =
=  с
с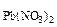 ·
·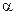 ·n
·n =
=  = 2,5·10-2 моль/л
= 2,5·10-2 моль/л
с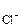 =
=  с
с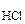 ·
·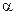 ·n
·n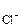 =
=  = 1·10-2 моль/л
= 1·10-2 моль/л
с ·с
·с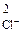 = 2,5·10
= 2,5·10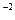 ·(1·10
·(1·10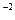 )2 = 2,5·10
)2 = 2,5·10
Так как 2,5·10 < 2·10-5 (ПР
< 2·10-5 (ПР ), то осадок PbCl2 не образуется.
), то осадок PbCl2 не образуется.
Ответ: осадок PbCl2 не образуется.
3. Составить схему коррозионного ГЭ, возникающего при контакте оловянной пластинки, площадью 35 см2 с медной в растворе хлороводородной кислоты. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 70 минут в процессе коррозии выделилось 1,5 см3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 80 минут потеря массы корродируемого металла составила 5,6 ∙10-3 г. Плотность металла 7,3 г/см3.
РЕШЕНИЕ:
По таблице находим значения стандартных электродных потенциалов олова (II) и меди (II):
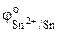 = - 0,14 В,
= - 0,14 В, 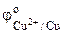 = 0,34 В.
= 0,34 В.
Так как 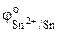 <
<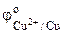 , то анодом в коррозионном ГЭ будет олово, катодом – медь.
, то анодом в коррозионном ГЭ будет олово, катодом – медь.
Составим схему коррозионного ГЭ:
А(-)Sn │ HCl │ Cu(+)K
или
А(-)Sn │ H+ │ Cu(+)K
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A(-)Sn – 2ē = Sn2+
На К(+)2Н+ + 2ē = Н2

Sn + 2H+ = Sn2+ + H2
Sn + 2HCl = SnCl2 + H2 – суммарная реакция процесса коррозии.
а)

| Рассчитываем объемный показатель коррозии (KV) по формуле:
KV =   , см3/м2∙час.
При расчете KV принимаем:
S – площадь поверхности анода, м2;
τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3. , см3/м2∙час.
При расчете KV принимаем:
S – площадь поверхности анода, м2;
τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3.
|
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород. Следовательно, Vгаза =  .
.
Тогда, KV =  =
=  367,3 см3/м2∙час.
367,3 см3/м2∙час.
Рассчитываем весовой показатель коррозии Km по формуле:
Km =  , г/м2∙час.
, г/м2∙час.
В процессе коррозии разрушению подвергается олово и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Sn) = 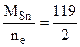 =59,5 г/моль,
=59,5 г/моль,
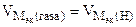 = 11200 см3/моль.
= 11200 см3/моль.
Km = 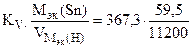 = 1,95 г/м2∙час.
= 1,95 г/м2∙час.
Ответ: KV = 367,3 см3/м2∙час.
Km = 1,95 г/м2∙час.
б)

| Рассчитываем весовой показатель коррозии Km по формуле:
Km =  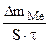 , г/м2∙час.
Коррозии подвергается олово.
Тогда потеря массы металла , г/м2∙час.
Коррозии подвергается олово.
Тогда потеря массы металла
 
|
При расчете Km принимаем:  - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час].
Тогда: Km = 
 =
=  = 1,2 г/м2∙час.
= 1,2 г/м2∙час.
Рассчитываем глубинный показатель коррозии по формуле:
П =  =
= 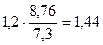 мм/год.
мм/год.
Ответ: Km = 1,2 г/м2∙час, П = 1,44 мм/год.
17. МЕТАЛЛЫ V – VI ГРУППЫ
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 607; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 5,6∙10-3 г
S = 35 см 2
ρMe = 7,3 г/см3
Km -?
П -?
5,6∙10-3 г
S = 35 см 2
ρMe = 7,3 г/см3
Km -?
П -?