
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составить ионно-молекулярное молекулярное уравнения гидролиза хлорида железа (III). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе
|
|
|
|
УРОВЕНЬ В
|
РЕШЕНИЕ:
FeCl3 диссоциирует в растворе:
FeCl3 → Fe3+ + 3Cl-
 Fe Cl3
Fe Cl3
Fe (OH)3 + H2SO4
cлаб. cильн.
Сокращенное ионно-молекулярное уравнение гидролиза:
|
|
Fe3+ + НОН <=> +, рН<7, среда
кислая
Молекулярное уравнение гидролиза:
FeCl3 + H2O <=> FeOHCl2 + HCl

 ,
,
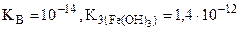 (табл.)
(табл.)

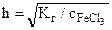 ;
;  =0,84
=0,84
pН= -1/2∙lgKг-1/2∙lg =
=
= 


Ответ: 
2. Используя справочные данные по ΔfH0(298K) и S0(298К) веществ определить равновесное парциальное давление СО при температуре 1000 К для реакции:
Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).

| РЕШЕНИЕ:
Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).
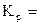 р р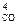
|
-2,3RTlgKp = ΔrH0(298K) – TΔrS0(298K)
Значения ΔfH0(298K) и S0(298K) веществ берем из табл.
| Fe3O4(к)+ | 4C(к) = | 3Fe(к) + | 4CO(г) | |
| ΔfH0(298K),кДж/моль | -1117,1 | 4(-110,5) | ||
| S0(298K), Дж/моль·К | 146,2 | 4·5,7 | 3·27,15 | 4·197,5 |
ΔrH0(298K)=[4ΔfH0(298K,CO(г))+3ΔfH0(298K, Fe(к))]-
-[ΔfH0(298K,Fe3O4(к))+ 4ΔfH0(298K,C(к))]
ΔrH0(298K) = 4(-110,5) – (-1117,1) = 675,1 кДж.
ΔrS0(298K) = [4 S0(298K, CO(г)) + 3S0(298K, Fe(к))] –
-[S0(298K, Fe3O4(к))+ 4S0(298K, C(к))]
ΔrS0(298K) = [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К
Kp = 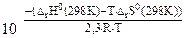
Kp = 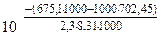 = 26,9
= 26,9
рCO =  атм.
атм.
Ответ: рCO = 2,3 атм.
3. При растворении 6 г сплава меди, железа и алюминия в хлороводородной кислоте выделилось 3 л водорода (н.у.) и получено 1,86 г нерастворившегося осадка (н.о.). Определить состав сплава (%мас.).
|
РЕШЕНИЕ:
ωме =  ∙ 100%
∙ 100%
 |
В хлороводородной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
Fe + 2HCl = FeCl2 + H2 (17.4)
2Al + 6HCl = 2AlCl3 + 3H2 (17.5)
Медь в этих условиях не растворяется, следовательно:
mн.о. = mCu = 1,86 г
mFe+Al = mспл – mCu= 6 – 1,86 = 4,14 г
Пусть х – масса железа в сплаве, г;
Fe - H2 (реакция 17.4)
56 г Fe - 22,4 л Н2
m г Fe - V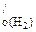
V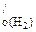 =
= 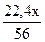 , л
, л
Тогда (4,14 – х) - масса алюминия в сплаве, г;
2 Al → 3H2 (реакция 17.5)
2∙27 г Al - 3·22,4 л Н2
(4,14 – х) г Al - V
V =
=  , л
, л
Суммарный объем выделившегося водорода:
V + V
+ V =
= +
+  = 3 л
= 3 л
m = 2,56 г
Следовательно 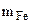 = 2,56 г,
= 2,56 г, 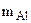 = 4,14 – 2,56 = 1,58 г
= 4,14 – 2,56 = 1,58 г
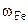 =
= 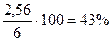
 =
=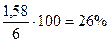
 =
=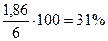
Ответ: состав сплава: 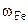 = 43%мас.,
= 43%мас.,  = 26%мас.,
= 26%мас.,
 = 31%мас.
= 31%мас.
1. По заданным термодинамическим уравнениям определить стандартную энтальпию образования PCl5(г)
|

| РЕШЕНИЕ: Стандартная энтальпия образования PCl5(г) есть тепловой эффект реакции образования |
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1279; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 0.01M
Kг -? pH-? h -?
0.01M
Kг -? pH-? h -?
 -?
-?

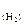 = 3 л
mн.о.=1,86 г %ωFe -? %ωAl -?
%ωCu -?
= 3 л
mн.о.=1,86 г %ωFe -? %ωAl -?
%ωCu -?