
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ А. 1. Используя справочные значения изменений стандартных энергий Гиббса образования веществ, определить возможность самопроизвольного протекания реакции:
|
|
|
|
МЕТАЛЛЫ VIII ГРУППЫ
1. Используя справочные значения изменений стандартных энергий Гиббса образования веществ, определить возможность самопроизвольного протекания реакции:
OsО4(к) +4Н2(г) = Os(к) + 4Н2О(ж) при стандартных условиях. Ответ мотивировать расчетом ΔrG°(298K).
| Дано: Уравнения химической реакции. |
| DrGo(298 K) -? |
РЕШЕНИЕ:
Возможность самопроизвольного протекания реакции при 298К определяется знаком величины изменения энергии Гиббса для данной реакции:
если ΔrG°(298 К) < 0, самопроизвольное протекание реакции при заданных условиях возможно;
если ΔrG°(298 К) > 0, то при заданной температуре реакция невозможна..
Значение ΔrG°(298 К) определяем по первому следствию из закона Гесса:
DrGo(298 K) = [DfGo(298 K, Os(к)) + 4DfGo(298 K, H2O(ж))] –
– [DfGo(298 K, OsO4(к)) + 4DfGo(298 K, Н2(г))]
| OsО4(к) | + 4Н2 (г) | = Os(к) | + 4 Н2О(ж) | |
| DfGo(298 K) кДж/моль | -302,5 | 4(-237,3) |
Тогда:
ΔrG°(298 К) = 4(-237,3) – (-302,5) = -646,7кДж.
Ответ: так как ΔrG°(298 К) < 0, то самопроизвольное протекание реакции возможно.
2. Вычислить концентрацию ионов железа в 0,01М растворе K3[Fe(CN)6], содержащем, кроме того, 0,02 моль/л цианида калия. Константа нестойкости иона [Fe(CN)6]3- в водном растворе равна 1.10-31.
Дано:
с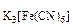 =0,01 моль/л, сKCN=0,02 моль/л, =0,01 моль/л, сKCN=0,02 моль/л,
 = 1.10-31 = 1.10-31
|
| [Fe3+] -? |
РЕШЕНИЕ:
Первичная диссоциация комплексных солей протекает по типу диссоциации сильных электролитов:
K3[Fe(CN)6]=[Fe(CN)6]3-+3К+ (17.1)
Концентрация комплексного иона [Fe(CN)6]3- равна 0,01 моль/л, так как из одной молекулы комплексной соли образуется один комплексный ион.
Константа нестойкости комплексного иона [Fe(CN)6]3- характеризует следующий равновесный процесс:
[Fe(CN)6]3- <=>Fe3+ + 6CN- (вторичная диссоциация) (17.2)
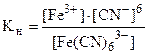 (17.3)
(17.3)
Присутствие цианида калия в растворе смещает равновесие диссо-циации комплексного иона (17.2) влево вследствие возрастания концентрации одноименного иона CN-, образующегося при диссоциации KCN:
КCN = К+ + СN-
После смещения равновесия устанавливается новое равновесие. Концентрацию Fe3+ в новом равновесии принимаем равной
х моль/л.
Общая равновесная концентрация [CN-] равна сумме концентраций CN-, образовавшихся при диссоциации КCN и [Fe(CN)6]3-:
[CN-] =  +
+ 
из [Fe(CN)6]3- из КCN
 = 6х моль/л из [Fe(CN)6]3-
= 6х моль/л из [Fe(CN)6]3-
 =
=  ·α·
·α· = 0,02·1·1 = 0,02 моль/л,
= 0,02·1·1 = 0,02 моль/л,
из КCN
так как КCN сильный электролит, α=1,  =1.
=1.
Тогда:
[CN-] = (6х + 0,02) моль/л.
Вследствие малости х, принимаем: 6х + 0,02 ≈ 0,02 моль/л.
Таким образом, выражение (17.3) примет вид:
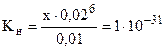 ,
,
откуда х = [Fe3+] =  1,56·10-23 моль/л
1,56·10-23 моль/л
Ответ: [Fe3+] = 1,56·10-23 моль/л.
3. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей: а) сульфата кобальта (II), б) хлорида палладия (II) (анод инертный). Какие продукты выделяются на аноде и катоде.

| РЕШЕНИЕ а) CoSO4= Co2+ + SO42-, K(-) A(+) инертный Co2+ + 2ē = Co SO42- 2H2O+2ē=H2+2OH- 2H2O-4ē=O2+4H+ |
На катоде выделяется Co и Н2, на аноде выделяется О2.
б) PdCl2 = Pd2+ + 2Cl-
K(-) A(+) инертный
Pd2+ + 2ē = Pd 2Cl - - 2ē = Cl2
H2O H2O
На катоде выделяется Pd, на аноде выделяется Cl2.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!