
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. Уравнять реакцию методом электронного баланса
|
|
|
|
УРОВЕНЬ А
МЕТАЛЛЫ VII ГРУППЫ
1. Уравнять реакцию методом электронного баланса. Указать окислитель и восстановитель:
FeCl2 + KMnO4 +HCl→FeCl3 + MnCl2+KCl + H2O
| Дано: Уравнение реакции |
| Уравнять реакцию, указать окислитель и восстановитель |
РЕШЕНИЕ:
Fe+2Cl2 + KMn+7O4 + HCl → Fe+3Cl3 + +Mn+2Cl2 + KCl + H2O
НОК ДМ

 восст-ль Fe+2 - e = Fe+3 5
восст-ль Fe+2 - e = Fe+3 5
окисл-ль Mn+7 + 5e = Mn+2 1
 |
5Fe+2 + Mn+7 = 5Fe+3 + Mn+2
Переносим полученные коэффициенты в молекулярное уравнение с учетом, что Cl- cодержится, также в 5 молекулах FeCl2 и определяем необходимое количество молекул HCl для получения продуктов реакции. Уравниваем Н и О → 4Н2О.
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O
1. Уравнять реакцию. Указать окислитель и восстановитель:
Na2S + KMnO4 + H2O → MnO2 + Na2SO4 + KOH
Определить Сэк(Na2S), если на взаимодействие с 4 г KMnO4 ушло 250 см3 раствора Na2S.
Дано:
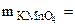 4 г 4 г
 = 250 см3 = 0,25 л = 250 см3 = 0,25 л
|
Уравнять реакцию, указать окислитель и восстановитель
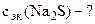
|
РЕШЕНИЕ:
Na2S-2 + KMn+7O4 + H2O→ Mn+4O2 + Na2S+6O4 + KOH
НОК ДМ

 восст-ль S-2 - 8e = S+6 3
восст-ль S-2 - 8e = S+6 3
окисл-ль Mn+7 + 3e = Mn+4 8
 |
3S-2 + 8Mn+7 = 3S0 + 8Mn+4
Переносим полученные коэффициенты в молекулярное уравнение. Уравниваем число ионов К+ и определяем количество воды → 4Н2О.
3Na2S +8KMnO4 + 4H2O =8MnO2 +3 Na2SO4 +8KOH
По закону эквивалентов: nэк(Na2S) = nэк(KMnO4)
 ;
;
 =
=  , г/моль
, г/моль
где ne - число электронов, принятых одной молекулой KMnO4.
 г/моль
г/моль
 =
=  моль/л
моль/л
Ответ: 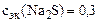 моль/л.
моль/л.
2. Уравнять реакцию. Указать окислитель и восстановитель:
Mn(OH)4 + HCl → MnCl2 + H2O + Cl2 Определить объем газа (н.у.), выделяющийся при взаимодействии 8 г гидроксида марганца (IV) с хлороводородной кислотой.
Дано:
m = 8 г = 8 г
|
V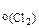 -? -?
|
РЕШЕНИЕ:
Mn+4(OH)4 + HCl-1 →Mn+2Cl2 + Cl20 +H2O

 НОК ДМ
НОК ДМ

 восст-ль Cl-1 - e = Cl0 2
восст-ль Cl-1 - e = Cl0 2
окисл-ль Mn+4 + 2e = Mn+2 1

2Cl-1 + Mn+4 = Cl20 + Mn+2
Переносим полученные коэффициенты в молекулярное уравнение, окончательно уравниваем его, учитывая при этом количество ионов Cl-1, необходимое для получения MnCl2
Mn(OH)4 + 4HCl = MnCl2 + Cl2 + 4H2O
М - Vo
- Vo
123 г - 22,4 л
8 г - х л
х =  = 1,46 л
= 1,46 л
Ответ: V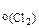 = 1,46 л
= 1,46 л
3. Уравнять реакцию. Указать окислитель и восстановитель:
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O. Определить массу оксида марганца (IV), необходимую для восстановления 150 см3 1 н раствора KСlO3.
Дано:
V =150 см3
=0,15 л
сэк(KClO3)= 1 моль/л =150 см3
=0,15 л
сэк(KClO3)= 1 моль/л
|
m -? -?
|
РЕШЕНИЕ:
Mn+4O2 + KCl+5O3 + KOH →
→ K2Mn+6O4 + KCl- + H2O
НОК ДМ

 восст-ль Mn+4 - 2e = Mn+6 3
восст-ль Mn+4 - 2e = Mn+6 3
окисл-ль Cl+5 + 6e = Cl- 1
 |
3Mn+4 + Cl+5 = 3Mn+6 + Cl-
Переносим полученные коэффициенты в молекулярное уравнение, уравниваем число К+, а затем Н и О:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
По закону эквивалентов:
nэк(KClO3) = nэк(MnO2)
V ·сэк(KClO3) =
·сэк(KClO3) = 
Mэк(MnO2) 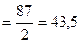 г/моль
г/моль
m = V
= V ·сэк(KClO3)∙
·сэк(KClO3)∙
m = 0,15·1∙43,5 = 6,5 г
= 0,15·1∙43,5 = 6,5 г
Ответ: m = 6,5 г
= 6,5 г
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1761; Нарушение авторских прав?; Мы поможем в написании вашей работы!