
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ А. 1. Можно ли восстановить оксид хрома (III) до металла при стандартных условиях:
|
|
|
|
1. Можно ли восстановить оксид хрома (III) до металла при стандартных условиях:
а) цинком;
б) кремнием.
Ответ подтвердить расчетом ΔrGo(298K) по ΔfGo(298K,B).
| Дано: Cr2O3; Zn; Si | РЕШЕНИЕ: а) Составляем уравнение реакции и рассчитываем изменение стандартной энергии Гиббса ΔrG0(298K) реакции, используя I следствие из закона Гесса. Значения стандартных энергий Гиббса образования веществ ΔfG0(298K,B) берем из таблицы cтандартных термодинамических величин. |
| Cr -? |
Cr2O3(к) + 3Zn(к) = 2Сr(к) + 3ZnO(к) (15.1)
ΔfG0(298K) -1058,97 0 0 3(-320,7)
кДж/моль
ΔrG0(298K, 15.1) = [3ΔfG0(298K, ZnO(к)) + 2ΔfG0(298K, Сr(к))] –
- [ΔfG0(298K, Cr2O3(к)) + 3ΔfG0(298K, Zn(к))] = 3(-320,7) -
-(-1058,97) = 96,87 кДж
Так как ΔrG0(298K, 1) > 0, то при стандартных условиях реакция невозможна.
б) Аналогично:
2Cr2O3(к) + 3Si(к) = 4Сr(к) + 3SiО2(к) (15.2)
ΔfG0(298K) 2(-1058,97) 0 0 3(-856,7)
кДж/моль
ΔrG0(298K, 15.2) = [3ΔfG0(298K, SiO2(к)) + 4ΔfG0(298K, Cr(к))] -
-[2ΔfG0(298K, Cr2O3(к)) + 3ΔfG0(298K, Si(к))] = 3(-856,7) –
-2(-1058,97) = -452,16 кДж
Так как ΔrG0(298K, 2) < 0, то самопроизвольное протекание реакции при стандартных условиях возможно.
Ответ: При стандартных условиях возможно восстановление хрома из оксида хрома (III) кремнием.
2. Определить рН раствора, при котором установилось равновесие: 2CrO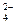 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O + H2O Равновесные концентрации ионов Cr2O
+ H2O Равновесные концентрации ионов Cr2O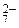 и CrO
и CrO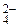 соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
Дано:
[Cr2O ]=4,5 моль/л
[CrO ]=4,5 моль/л
[CrO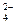 ]=0,001 моль/л
Кс = 1,1·1018 ]=0,001 моль/л
Кс = 1,1·1018
|
| рН -? |
РЕШЕНИЕ:
2CrO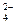 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O + H2O
+ H2O
рН = -lg[H+]
Kc = 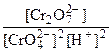
[H+] =  =
= моль/л
моль/л
рН = -lg2,02·10-6 = 5,7
Ответ: рН = 5,7
3. Шестивалентный элемент образует оксид, содержащий 20,71% масс. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.

| РЕШЕНИЕ:
По закону эквивалентов:
nэк(О2) = nэк(Э)
  Мэк(О) = 8 г/моль
Мэк(О) = 8 г/моль
|
Мэк(Э) = 
mокс = mэ + 
mэ = 100 -  = 100 – 20,71 = 79,29 г.
= 100 – 20,71 = 79,29 г.
Мэк(Э) = 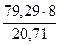 = 30,63 г/моль
= 30,63 г/моль
Мэк(Э) =  , где В – валентность элемента.
, где В – валентность элемента.
Мэ = Мэк(Э)∙В = 30,63∙6 = 183,77 г/моль, что соответствует молекулярной массе атома вольфрама.
Ответ: Мэк(Э) = 30,63 г/моль; элемент – W.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1861; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 20,71% масс.
В = 6
Мэк(Э) -?
Э -?
20,71% масс.
В = 6
Мэк(Э) -?
Э -?