
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Написать уравнения диссоциации этих соединений в водных растворах
|
|
|
|
Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединениях
УРОВЕНЬ А
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
K4[Mo(CN)8], [PtCl4(NH3)2].
| Дано: K4[Mo(CN)8], [PtCl4(NH3)2] Заряд комплексного иона-? |
| Меn+ -? кч -? |
РЕШЕНИЕ:
Диссоциация комплексных соединений протекает с отщеплением ионов внешней сферы по типу диссоциации сильных электролитов:
K4[Mo(CN)8] = 4К+ + [Mo(CN)8]4-
Заряд комплексного иона [Mo(CN)8]4- равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
Вторичная диссоциация комплексного иона обратима и протекает по типу диссоциации слабого электролита:
[Mo(CN)8]4- <=> Мох + 8 CN-
Степень окисления комплексообразователя (х) определяется по заряду комплексного иона:
х
[Mo(CN)8] 4-
х + 8·(-1) = -4, откуда х= + 4, т.е. заряд комплексообразователя Мо4+.
Координационное число комплексообразователя (Мо4+) равно суммарному числу лигандов (CN-), окружающих комплексообразователь, т.е. 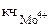 = 8.
= 8.
Так как соединение [PtCl4(NH3)2] не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация:
[Pt(NH3)2CI4]0 <=> Рtx + 2NH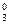 + 4Cl-
+ 4Cl-
x + 2·0 + 4·(-1) = 0, x = +4,
т.е. заряд комплексообразователя Рt4+, а  Pt4+ = 6.
Pt4+ = 6.
Ответ: [Mo(CN)8]4-,[PtCl4(NH3)2]0; Мо4+, Pt4+; 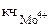 = 8;
= 8;
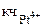 = 6.
= 6.
2. Константа нестойкости комплексных ионов [Fe(CN)6]4- и [Fe(CN)6]3- соответственно равны 1·10-24 и 1·10-31. Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным.
Дано:
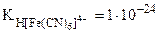
 
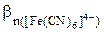 -? -?
 -? -?
| РЕШЕНИЕ: Диссоциация комплексных ионов процесс обратимый и количественно описываются константами нестойкости. [Fe(CN)6]4- <=> Fe2+ + 6CN- |
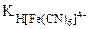
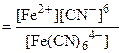 = 1·10-24
= 1·10-24
[Fe(CN)6]3- <=> Fe3+ + 6CN-

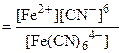 = 1·10-31
= 1·10-31
Константы устойчивости – константы равновесия обратных процессов (образования комплексных ионов).
Fe2+ + 6CN- <=> [Fe(CN)6]4-
 =1024
=1024
Fe3+ + 6CN- <=> [Fe(CN)6]3-
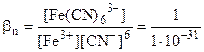 = 1031
= 1031
Значение константы устойчивости комплексного иона [Fe(CN)6]3- больше константы устойчивости комплексного иона [Fe(CN)6]4-. Значит комплексный ион [Fe(CN)6]3- более прочный.
Ответ: Комплексный ион [Fe(CN)6]3- более прочный.
3. Составить формулы следующих комплексных соединений с координационным числом платины (IV) равном шести PtCl4·6NH3; PtCl4·4NH3; PtCl4·2NH3. Написать уравнения диссоциации этих солей в водном растворе и назвать их.
Дано:
PtCl4·6NH3
PtCl4·4NH3
PtCl4·2NH3
 Комплексные соединения-?
Комплексные соединения-?
| РЕШЕНИЕ: В состав внутренней сферы включается шесть лигандов. В первую очередь – молекулы аммиака и затем до координационного числа шесть – ионы хлора. Остальные ионы хлора образуют внешнюю сферу. |
PtCl4·6NH3 → [Pt(NH3)6]Cl4 = [Pt(NH3)6]4+ + 4Cl-
[Pt(NH3)6]4+ <=> Pt4+ + 6NH03
PtCl4·4NH3 → [Pt(NH3)4Cl2]Cl2 = [Pt(NH3)4Cl2]2+ + 2Cl-
[Pt(NH3)4Cl2]2+ <=> Pt4+ + 4NH03 + 2Cl-
PtCl4 ·2NH3 → [Pt(NH3)2Cl4] <=> Pt4+ + 2NH03 + 4Cl-
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV)
[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV)
[Pt(NH3)2Cl4] – тетрахлородиамминплатина.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1439; Нарушение авторских прав?; Мы поможем в написании вашей работы!