
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Систематические и традиционные названия простых веществ
|
|
|
|
Принципы химической номенклатуры – химические формулы (простейшая, молекулярная, графическая) и химические названия соединений (систематическое, традиционное, специальное, тривиальное).
Классификация химических соединений по составу.
Классификация химических элементов.
 Классификация химических элементов основана на положении элементов в периодической системе Д.И. Менделеева, которое определяется характером электронного строения атомов химических элементов. Графическим отражением на плоскости периодической системы химических элементов являются различные формы периодических таблиц – например, короткопериодная таблица 1.2. В соответствии с принципом периодичности периодическая таблица состоит из шести полных и седьмого незавершенного периодов, содержащих соответственно – 2, 8, 8, 18, 18, 32 и 23 химических элементов. Первые три периода называют малыми, а 4 – 7 – большими периодами.
Классификация химических элементов основана на положении элементов в периодической системе Д.И. Менделеева, которое определяется характером электронного строения атомов химических элементов. Графическим отражением на плоскости периодической системы химических элементов являются различные формы периодических таблиц – например, короткопериодная таблица 1.2. В соответствии с принципом периодичности периодическая таблица состоит из шести полных и седьмого незавершенного периодов, содержащих соответственно – 2, 8, 8, 18, 18, 32 и 23 химических элементов. Первые три периода называют малыми, а 4 – 7 – большими периодами.
Распределение элементов по периодам приводит к формированию в периодических таблицах вертикальных столбцов, образующих восемь групп. Наличие разного количества элементов в малых и больших периодах приводит к формированию в пределах каждой группы двух подгрупп – главной и побочной, для обозначения которых используют буквы «А» и «В». Главные подгруппы начинаются с элементов 2 периода, а побочные – с элементов 4 (первого большого) периода. Особое место в периодических таблицах занимают IIIB и VIIIB подгруппы. В IIIB подгруппу, наряду со скандием, иттрием, лантаном и актинием, входят два семейства по четырнадцать элементов – лантаноидов и актиноидов. Восьмая группа также содержит «избыточное» количество (12) элементов побочной VIIIB подгруппы – по три элемента из каждого большого периода.
Таблица 2. Короткопериодная таблица периодической системы.
| Период | Ряд | Группа | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| I | H 1s1 | He 1s2 | |||||||||
| II | Li 3 2s1 | Be 4 2s2 | B5 2s22p1 | C6 2s22p2 | N7 2s22p3 | O8 2s22p4 | F9 2s22p5 | Ne10 2s22p6 | |||
| III | Na 11 3s1 | Mg 12 3s2 | Al13 3s23p1 | Si14 3s23p2 | P15 3s23p3 | S16 3s23p4 | Cl17 3s23p5 | Ar18 3s23p6 | |||
| IV | K 19 4s1 | Ca 20 4s2 | Sc21 3d14s2 | Ti22 3d24s2 | V23 3d34s2 | Cr24 3d54s1 | Mn25 3d54s2 | Fe26 3d64s2 | Co27 3d74s2 | N i 28 3d84s2 | |
| Cu29 4s13d10 | Zn30 4s23d10 | Ga31 4s24p1 | Ge32 4s24p2 | As33 4s24p3 | Se34 4s24p4 | Br35 4s24p5 | Kr36 4s24p6 | ||||
| V | Rb 37 5s1 | Sr 38 5s2 | Y39 4d15s2 | Zr40 4d25s2 | Nb41 4d35s2 | Mo42 4d55s1 | Tc43 4d55s2 | Ru44 4d75s1 | Rh45 4d85s1 | Pd46 4d105s0 | |
| Ag47 4d105s1 | Cd48 4d305s2 | In49 5s25p1 | Sn50 5s25p2 | Sb51 5s25p3 | Te52 5s25p4 | I53 5s25p5 | Xe54 5s25p6 | ||||
| VI | Cs 55 6s1 | Ba 56 6s2 | La*57 5d16s2 | Hf72 5d26s2 | Ta73 5d36s2 | W74 5d46s2 | Re75 5d56s2 | Os76 5d66s2 | Ir77 5d76s2 | Pt78 5d96s2 | |
| Au79 5d106s1 | Hg80 5d106s2 | Tl81 6s26p1 | Ge82 6s26p2 | Bi83 6s26p3 | Po84 6s26p4 | At85 6s26p5 | Rn86 6s26p6 | ||||
| VII | Fr 87 7s1 | Ra 88 7s2 | Ac * *89 6d17s2 | Rf104 6d27s2 | Db105 6d37s2 | Sg106 6d47s2 | Bh107 6d57s2 | Hs108 6d67s2 | Mt109 6d87s2 | [ ] 110 | |
| [ ] 111 | [ ] 112 |
*Лантаноиды
| Ce58 4f2 6s2 | Pr59 4f3 6s2 | Nd60 4f4 6s2 | Pm61 4f5 6s2 | Sm62 4f6 6s2 | Eu63 4f7 6s2 | Gd64 4f7 5d1 6s2 | Tb65 4f9 6s2 | Dy66 4f10 6s2 | Ho67 4f11 6s2 | Er68 4f12 6s2 | Tm69 4f13 6s2 | Yb70 4f14 6s2 | Lu71 4f14 5d1 6s2 |
**Актиноиды
| Th90 6d2 7s2 | Pa91 5f2 6d1 7s2 | U92 5f3 6d1 7s2 | Np93 4f4 6d1 7s2 | Pu94 5f6 7s2 | Am95 5f7 7s2 | Cm96 5f7 6d1 7s2 | Bk97 5f8 6d1 7s2 | Cf98 5f10 7s2 | Es99 5f11 7s2 | Fm100 5f12 7s2 | Md101 5f13 7s2 | No102 5f14 7s2 | Lr103 5f14 6d1 7s2 |
Элементы главных подгрупп образуют семейство непереходных, а элементы побочных подгрупп – семейство переходных элементов. В зависимости от природы внешних электронов (табл. 1.2.) непереходные элементы IA и IIA подгрупп называют s-элементами, а элементы IIIA-VIIIA подгрупп – р-элементами. Переходные элементы также подразделяются на два подсемейства: актиноиды и лантаноиды назвают f-элементами, а остальные элементы побочных подгрупп – d- элементами. Поскольку в виде простых веществ все переходные элементы являются типичными металлами, то семейство переходных элементов и подсемейства d- и f-элементов часто называют – переходные металлы, d-металлы и f-металлы.
В каждой главной подгруппе элементы второго и третьего периода относятся к типическим непереходным элементам, а элементы 4-7 периодов образуют подсемейство непереходных элементов, называемые по имени элемента четвертого периода. Например, кислород и сера являются типическими элементами VIA подгруппы, а селен, теллур и полоний образуют подсемейство селена. Непереходные элементы IA, IIA, VIA, VIIA и VIIIA подгрупп имеют специальные названия – щелочные металлы, щелочноземельные металлы, халькогены (рождающие руды), галогены (рождающие соли) и благородные газы соответственно.
Совокупность переходных d-элементов каждой из IB-VIIB подгруппы называют по имени d-элемента четвертого периода: IB – подгруппа меди (Cu, Ag, Au), IIB – подгруппа цинка (Zn, Cd, Hg), IIIB - подгруппа скандия (Sc, Y, La, Ac), IVB –подгруппа титана (Ti, Zr, Hf, Rf), VB - подгруппа ванадия (V, Nb, Ta, Db), VIB – подгруппа хрома (Cr, Mo, W, Sg), VIIB – подгруппа марганца (Mn, Tc, Re, Bh). Переходные d-элементы VIIIB подгруппы образуют два подсемейства: железа (Fe, Co, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Пример. Классифицируйте следующие химические элементы: Ba, Si, Te, Mo, Rh, Tb, Np.
Решение. Ba – непереходный s-элемент второй группы и шестого периода, подгруппа щелочноземельных металлов, подсемейство кальция;
Si – непереходный р-элемент четвертой группы и третьего периода, типический элемент IVA подгруппы;
Te – непереходный р-элемент шестой группы и пятого периода, подгруппа халькогенов, подсемейство селена;
Mo – переходный d-элемент шестой группы и пятого периода, подгруппа хрома;
Rh – переходный d-элемент восьмой группы и пятого периода, семейство платиновых металлов;
Tb – переходный f-элемент третьей группы и шестого периода, семейство лантаноидов;
Np – переходный f-элемент третьей группы и седьмого периода, семейство актиноидов.
 Упражнения:
Упражнения:
4. Какие химические элементы VII группы относятся: к переходным и непереходным элементам и как называются подгруппы непереходных и переходных элементов? Как называют совокупность следующих элементов VIIА подгруппы: фтор, хлор, бром, иод, астат.
5. Классифицируйте следующие химические элементы: Rb, Y, Ta, Be, Sg, In, Ni, C, Pd, As, Sm, O, Am, I, Ne.
 Химическое соединение – совокупность химических структурных элементов (атомов или ионов), объединенных химическим взаимодействием, называемым химической связью. Химическая связь – взаимодействие между химическими структурными элементами вещества, сопровождающееся изменением в их электронном строении в результате обобществления электронов и приводящее к понижению энергии системы.
Химическое соединение – совокупность химических структурных элементов (атомов или ионов), объединенных химическим взаимодействием, называемым химической связью. Химическая связь – взаимодействие между химическими структурными элементами вещества, сопровождающееся изменением в их электронном строении в результате обобществления электронов и приводящее к понижению энергии системы.
В зависимости от состава химические соединения подразделяют на простые и сложные.
 | |||
 |
Схема 1. Простые и сложные химические соединения.
Аллотропия – это способность химических элементов образовывать несколько разных простых веществ, отличающихся по своим свойствам. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллической решетке (аллотропия формы). Например, селен в виде твердого при нормальных условиях простого вещества существует в виде: красного селена, в узлах кристаллической которого находятся циклические молекулы Se¥, серого селена - кристаллы образованы зигзагообразными цепями Se¥, и красно-коричневой стекловидной модификации, образованной неупорядоченно расположенными молекулами Se¥ разной длины. Красный и серый селен являются примерами аллотропных модификаций состава, а красный и красно-коричневый селен – примерами аллотропных модификаций формы. Аллотропия – частный случай явления полиморфизма. Способность элемента к образованию аллотропных модификаций связана с электронным строением атома.
Химические соединения, содержащие атомы или ионы двух химических элементов называются бинарными (CS2, NaCl, SiCl4), а более двух химических элементов - многоэлементными (Na2SO4, SeO2F2, K3[Fe(CN)6]).
 Упражнения:
Упражнения:
6. Какие химические соединения называются простыми, сложными?
7. Привести примеры аллотропных модификаций состава и формы для кислорода и серы как простых веществ.
8. Что такое бинарные химические соединения? Приведите примеры бинарных химических соединений щелочноземельных металлов с галогенами, халькогенами, азотом, фосфором, водородом.
9. Какие из следующих соединений серы относятся к простым, сложным бинарным и сложным многоэлементным соединениям: (SO3)3, S8, SO2Cl2, FeS2, Na2SO4?
 Химическая номенклатура - это язык химии, который включает в себя формулы химических соединений, отображающих состав веществ с помощью символов химических элементов, числовых индексов и других знаков, и названия соединений – изображение состава веществ с помощью слова или группы слов. Переход от химических формул к названиям и наоборот определяется системой номенклатурных правил. Современная номенклатура разработана Международным союзом теоретической и прикладной химии (ИЮПАК, IUPAC). В основу номенклатуры положен состав химических соединений.
Химическая номенклатура - это язык химии, который включает в себя формулы химических соединений, отображающих состав веществ с помощью символов химических элементов, числовых индексов и других знаков, и названия соединений – изображение состава веществ с помощью слова или группы слов. Переход от химических формул к названиям и наоборот определяется системой номенклатурных правил. Современная номенклатура разработана Международным союзом теоретической и прикладной химии (ИЮПАК, IUPAC). В основу номенклатуры положен состав химических соединений.
По номенклатурным правилам каждое вещество в соответствии с его формулой получает систематическое название, полностью отражающее его состав (N2 – диазот, Hg2Cl2 – дихлорид диртути). Для ограниченного числа распространенных кислот и их солей правила ИЮПАК рекомендуют использование традиционных названий (H2SO4 – серная кислота, Na2SO4 – сульфат натрия), хотя они не дают точного представления о составе и требуют запоминания. По правилам ИЮПАК допускается использование небольшого числа специальных исторически сложившихся названий – например, вода H2O, аммиак NH3, аммоний NH4+, гидразин N2H4. В технической литературе иногда применяют тривиальные названия: соляная кислота HCl, сода Na2CO3, медный купорос CuSO4×5H2O, нашатырь NH4Cl.
В химической практике в основном используется три типа формул химических соединений – простейшая (эмпирическая), молекулярная и графическая (структурно-графическая). Простейшая формула отражает минимальное соотношение между атомами химических элементов в соединении: S для всех аллотропных модификаций серы как простого вещества, CH для бензола и т.д. Молекулярная формула отображает истинный состав молекул или сложных ионов: S2, S8, S¥, C6H6, C2O42-. Графическая формула, наряду с истинным составом, отображает расположение атомов химических элементов в соединении и кратность химических связей между ними. Каждая двухцентровая двухэлектронная химическая связь между атомами изображается отдельной «черточкой», а делокализованные между несколькими атома связи – кривой, охватывающей эти атомы:
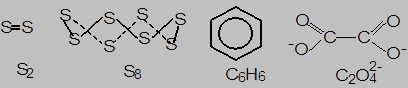
Для отображения состава и структуры соединений в молекулярных формулах соединений, наряду с символами химических элементов, используются: числовые индексы; круглые, фигурные и квадратные скобки; математические символы «×» или «´»; буквы греческого алфавита; буквенные обозначения типа кристаллической решетки (куб. – кубическая, тетр. – тетрагональная, монокл. – моноклинная, гекс. – гексагональная, триг. – тригональная, трикл. – триклинная): NH4, NH4+, (NH4)2SO4, [Co(NH3)6]Cl3, Na2SO4×5H2O, Na2SO4´5H2O, a-Pb, S(ромб).
 Упражнения:
Упражнения:
10. В одинаковой ли мере обоснована запись графических формул для соединений с молекулярной и ионной структурой?
11. Приведите простейшие, молекулярные и графические формулы следующих химических соединений: аммиак, пероксид водорода, азот, белый фосфор, озон, гелий.
12. Приведите по три примера формул химических соединений использующих, наряду с символами химических элементов, другие обозначения: числовые индексы, круглые и квадратные скобки, математический символ «×» или «´», буквы греческого алфавита.
 Систематические названия простых веществ образуются из названия химического элемента с указанием с помощью числовых приставок (2 - ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта, 9 – нона, 10 – дека, 11 – ундека, 12 – додека) числа атомов в молекуле: H2 диводород, О3 трикислород, Р4 тетрафосфор, S8 октасера, B12 додекабор. Неопределенное число атомов обозначается приставкой «поли-» - Sn полисера, Pn полифосфор. Для обозначения твердых аллотропных модификаций простых веществ допускается использование греческих букв a, b, g, d и т.д., начиная с наиболее низкотемпературной модификации: a-Sn – альфа-олово, b-Sn – бета олово, g-Sn – гамма-олово. Вместо греческих букв для твердых аллотропных модификаций может быть использовано буквенное обозначение типа кристаллической решетки: b-Sn, или Sn(гекс.) – бета-олово, или олово гексагональное. Аморфное состояние твердых простых веществ указывают буквенным обозначением «ам.»: C(ам.).
Систематические названия простых веществ образуются из названия химического элемента с указанием с помощью числовых приставок (2 - ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта, 9 – нона, 10 – дека, 11 – ундека, 12 – додека) числа атомов в молекуле: H2 диводород, О3 трикислород, Р4 тетрафосфор, S8 октасера, B12 додекабор. Неопределенное число атомов обозначается приставкой «поли-» - Sn полисера, Pn полифосфор. Для обозначения твердых аллотропных модификаций простых веществ допускается использование греческих букв a, b, g, d и т.д., начиная с наиболее низкотемпературной модификации: a-Sn – альфа-олово, b-Sn – бета олово, g-Sn – гамма-олово. Вместо греческих букв для твердых аллотропных модификаций может быть использовано буквенное обозначение типа кристаллической решетки: b-Sn, или Sn(гекс.) – бета-олово, или олово гексагональное. Аморфное состояние твердых простых веществ указывают буквенным обозначением «ам.»: C(ам.).
Для ограниченного круга простых веществ допускается использование традиционных названий: Н2, Hal2, О2, N2 - молекулярный водород, галоген (фтор, хлор и т.д.), кислород, азот; О3 озон; S8 кристаллическая сера; P4 белый фосфор и др.
 Упражнения:
Упражнения:
13. Приведите систематическое и традиционное название простых веществ: Ne, Cl2, O2, S2, S8, Sn, N2, P4, Pn, B12.
14. На примере серы продемонстрируйте указание в названии и формуле простых веществ существование их в различных аллотропных модификациях формы.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1361; Нарушение авторских прав?; Мы поможем в написании вашей работы!