
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды. Функциональная классификация сложных неорганических соединений
|
|
|
|
Функциональная классификация сложных неорганических соединений

Традиционно по химическим свойствам среди основных классов неорганических соединений выделяют оксиды, гидроксиды, бескислородные кислоты, соли и галогенангидриды (см. схему 2):
 Упражнения:
Упражнения:
25. Приведите примеры химических соединений, относящихся к различным функциональным классам сложных неорганических соединений: несолеобразующий оксид, основной оксид, амфотерный оксид, кислотный оксид, основной гидроксид (основание), амфотерный гидроксид, кислотный гидроксид (оксокислота), галогенангидрид, бескислородная кислота, средняя соль, основная соль, кислая соль, двойная соль, смешанная соль.

Схема 2. Основные классы сложных неорганических соединений.
 Оксидами называются бинарные соединения элементов с кислородом в степени окисления –2. Характерной особенностью строения оксидов является наличие в них только одного типа химической связи: элемент-кислород. В соответствии с формальными степенями окисления элемента (Эя+, z = 1-8) и кислорода О2- возможно образование оксидов с простейшими формулами: Э2О, ЭО, Э2О3, ЭО2, Э2О5. ЭО3, Э2О7, ЭО4. Истинные молекулярные формулы оксидов соответствуют целому числу структурных единиц, определяемых простейшей формулой. Например, молекулярная формула оксида фосфора (V) P4O10 соответствует его удвоенной простейшей формуле P2O5. В графических формулах оксидов число химических связей, образуемых каждым атомом химического элемента, принимается равным его формальной степени окисления. Каждый атом кислорода может образовывать две химические связи либо непосредственно с одним атомом элемента, либо, выступая в качестве «мостикового атома», по одной связи с двумя атомами элемента. Важно отметить, что в оксиды характеризуются наличием не более одного мостикового атома кислорода между двумя атомами химических элементов. Это показывает, что бинарные соединения с кислородом, характеризующиеся наличием двух и более мостиковых атомов кислорода, к оксидам не относятся. Например, как видно из графических формул:
Оксидами называются бинарные соединения элементов с кислородом в степени окисления –2. Характерной особенностью строения оксидов является наличие в них только одного типа химической связи: элемент-кислород. В соответствии с формальными степенями окисления элемента (Эя+, z = 1-8) и кислорода О2- возможно образование оксидов с простейшими формулами: Э2О, ЭО, Э2О3, ЭО2, Э2О5. ЭО3, Э2О7, ЭО4. Истинные молекулярные формулы оксидов соответствуют целому числу структурных единиц, определяемых простейшей формулой. Например, молекулярная формула оксида фосфора (V) P4O10 соответствует его удвоенной простейшей формуле P2O5. В графических формулах оксидов число химических связей, образуемых каждым атомом химического элемента, принимается равным его формальной степени окисления. Каждый атом кислорода может образовывать две химические связи либо непосредственно с одним атомом элемента, либо, выступая в качестве «мостикового атома», по одной связи с двумя атомами элемента. Важно отметить, что в оксиды характеризуются наличием не более одного мостикового атома кислорода между двумя атомами химических элементов. Это показывает, что бинарные соединения с кислородом, характеризующиеся наличием двух и более мостиковых атомов кислорода, к оксидам не относятся. Например, как видно из графических формул:
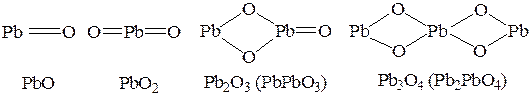
Pb2O3 (PbO×PbO2), Pb3O4 (2PbO×PbO2), называемые ранее смешанными оксидами, следует рассматривать как свинцовые соли метасвинцовой (H2PbO3) и ортосвинцовой (H4PbO4) кислот.
 Характерной особенностью строения пероксидов является наличие в их структурах кислородной группировки из O22- с непосредственной химической связью между двумя атомами кислорода {-O-O-} – например, Na2O2, BaO2. В связи с этим, несмотря на формальное подобие молекулярных формул ЭО2, BaO2 относится к пероксидам, а PbO2 – к оксидам.
Характерной особенностью строения пероксидов является наличие в их структурах кислородной группировки из O22- с непосредственной химической связью между двумя атомами кислорода {-O-O-} – например, Na2O2, BaO2. В связи с этим, несмотря на формальное подобие молекулярных формул ЭО2, BaO2 относится к пероксидам, а PbO2 – к оксидам.
Систематические названия оксидов и пероксидов образуются в соответствии с общими правилами для названий бинарных соединений. Названия складываются из слова оксид (пероксид) и русского названия элемента в родительном падеже с указанием (для элементов с переменной степенью окисления) римскими цифрами в круглых скобках степени окисления элемента:
Na2O - оксид натрия, Fe2O3 - оксид железа (III),
H2O2 - пероксид водорода, BaO2 – пероксид бария.
Либо в названиях оксидов используются латинские числовые приставки:
Na2O - оксид динатрия, Fe2O3 - триоксид дижелеза.
Некоторые оксиды и пероксиды имеют тривиальные названия (приложение 2.), используемые в основном в технической литературе.
В зависимости от способности оксидов к образованию солей при взаимодействию с кислотами, кислотными оксидами, или основаниями и основными оксидами, они подразделяются на солеобразующие и несолеобразующие (CO, NO, N2O) оксиды. Солеобразующие оксиды подразделяются на основные, амфотерные и кислотные:




 :
:
 |  | ||||||||
 | |||||||||
 | |||||||||
 | |||||||||
Схема 3. Классификация солеобразующих оксидов.
Основные оксиды с преимущественно ионным характером химической связи Э-О образуют прочные ионные кристаллические решетки с высокими температурами кипения и плавления. В результате этого при нормальных условиях они существуют в виде твердых кристаллических веществ. Такие оксиды образуют наименее электроотрицательные элементы периодической системы с относительно низкой степенью окисления – например, катионы щелочных и щелочноземельных металлов, ряд переходных металлов в низких степенях окисления.
Для кислотных оксидов с преимущественно ковалентным характером связи Э-О характерны менее прочные молекулярные кристаллические решетки с относительно низкими температурами кипения и плавления. Как следствие этого, типичные кислотные оксиды при нормальных условиях являются газами – CO2, SO2, летучими жидкостями, или лекгоплавкими твердыми веществами – (SO3)3 (tкип. = 44,8 оС, tпл. = 16,8 оС). Кислотные оксиды образуют электроотрицательные химические элементы (неметаллы или переходные металлы с высокой степенью окисления).
Амфотерные оксиды характеризуются ионно-ковалентным характером химической связи Э-О и в основном образуют полимерные структуры. При нормальных условиях это твердые вещества. Образованию амфотерных оксидов способствует как промежуточное значение относительной электроотрицательности химического элемента, так и средние значения его степени окисления. Например, увеличение степени окисления хрома: Сr2+®Cr3+®Cr6+ приводит к ослаблению степени ионности и усилению ковалентности связи Cr-O в оксидах и, как следствие этого, к закономерному переходу от основного оксида CrO к амфотерному Cr2O3 и кислотному оксиду CrO3
В соответствии с характером химической связи основные и кислотные оксиды взаимодействуют с водой с образованием соответствующих основных и кислотных гидроксидов – оснований и кислородсодержащих кислот (оксокислот):
BaO + H2O = Ba(OH)2
SO3 + H2О = Н2SO4 {SO2(OH)2)}
Взаимодействие основных оксидов с кислотами, а кислотных оксидов с основаниями сопровождается образованием соли и воды:
BaO + 2HCl = BaCl2 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
Различный характер химической связи Э-О в кислотных и основных оксидах определяет эффективное взаимодействие их между собой с образование оксосолей: BaO + SO3 = BaSO4
Кислотно-основные свойства амфотерных оксидов выражены значительно слабее. С водой большинство амфотерных оксидов практически не взаимодействуют. Их кислотно-основная двойственность проявляется при взаимодействии с сильными основаниями и кислотами, а также с типично основными и кислотными оксидами:
ZnO + 2HCl = ZnCl2 + 2H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH (сплав) = Na2ZnO2 + H2O
ZnO + SO3 = ZnSO4
ZnO + Na2O (сплав) = Na2ZnO2
Следует отметить, что образование оксосолей на основе амфотерных оксидов происходит только в расплавах. В водных растворах продуктами их взаимодействия с основаниями являются соли, содержащие в качестве аниона гидроксокомплексы.
 Упражнения:
Упражнения:
26. Приведите систематические названия оксидов, распределите оксиды по классам: K2O, BeO, Al2O3, OsO4, CO, CO2, ZnO, N2O, NiO, N2O5, Cr2O3, CrO3, Mn2O7. Какие из данных оксидов будут вступать в реакцию: а) с соляной кислотой, б) с гидроксидом натрия, в) и с соляной кислотой, и с гидроксидом натрия; записать уравнения химических реакций.
27. Указать, какая из приведенных графических формул отвечает оксиду Mn (VII) и почему:
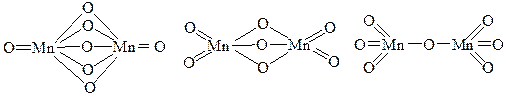
28. Приведите молекулярные и графические формулы оксидов: магния, алюминия, азота (IV), азота (I), фосфора (V), серы (VI), хлора (VII), марганца (VII), хрома (III). Приведите реакции гидратации (взаимодействия с водой) этих оксидов.
29. Напишите реакции, демонстрирующие кислотный характер следующих оксидов: CrO3, TeO3, Сl2O3, NO2, SeO2.
30. Приведите графические формулы, отражающие молекулярный состав оксидов фосфора(III) P4O6 и фосфора(V) P4O10.
31. На основании структурных формул объясните, какие из приведенных бинарных кислородных соединений относятся к оксидам:
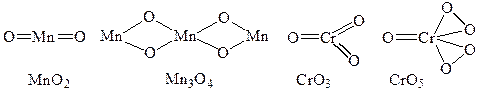
32. Приведите реакции, демонстрирующих кислотно-основные свойства оксидов: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7, CrO, Cr2O3, CrO3.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1037; Нарушение авторских прав?; Мы поможем в написании вашей работы!