
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
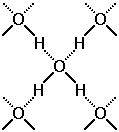
Водородные связи между молекулами воды (обозначены пунктиром)
|
|
|
|
Тема: Водородная связь
 План лекции:
План лекции:
- Основные понятия о водородной связи.

Наличие в молекулах H2O неподеленных электронных пар у атомов кислорода и положительно заряженных атомов водорода приводит к совершенно особому взаимодействию между молекулами, называемому ВОДОРОДНОЙ СВЯЗЬЮ (см. рисунок). В отличие от всех уже знакомых нам видов химической связи эта связь – межмолекулярная.
Водородная связь (на рисунке она обозначена пунктиром) возникает при взаимодействии обедненного электронами атома водорода одной молекулы воды с неподеленной электронной парой атома кислорода другой молекулы воды.
Водородная связь является частным случаем межмолекулярых связей. Считается, что она обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Поэтому водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF. Например, молекулы HF связаны между собой водородными связями, которые на рисунке показаны пунктирными линиями:

Водородные связи приблизительно в 20 раз менее прочные, чем ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0 °С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рисунке. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет именно такую упорядоченную структуру, которая показана на рисунке.
Тема: ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ

План лекции:
- Основные классы неорганических соединений.
- Основания. Химические свойства.
- Оксиды. Их виды, химические свойства.
- Кислоты. Классификация и их химические свойства.
- Соли. Классификация и их химические свойства.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 1627; Нарушение авторских прав?; Мы поможем в написании вашей работы!