
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: Гидролиз
План лекции:
- Понятие - гидролиз.
- Механизм составления реакции гидролиза.
 Гидролиз (от гидро... и греч. lýsis — разложение, распад), реакция ионного обмена между различными веществами и водой. В общем виде Гидролиз можно представить уравнением:
Гидролиз (от гидро... и греч. lýsis — разложение, распад), реакция ионного обмена между различными веществами и водой. В общем виде Гидролиз можно представить уравнением:
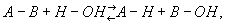
где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты гидролиза.
Равновесие в процессе гидролиза солей подчиняется действующих масс закону. Если в результате гидролиза образуется нерастворимое или легколетучее вещество. Гидролиз идёт практически до полного разложения исходной соли. В остальных случаях гидролиз солей проходит тем полнее, чем слабее соответствующая соли кислота или основание.
Если гидролизу подвергается соль, образованная слабой кислотой и сильным основанием, например KCN, раствор имеет щелочную реакцию; это объясняется тем, что анион слабой кислоты частично связывает образовавшиеся при диссоциации воды ионы Н+ и в растворе остаётся избыток ионов OH-:
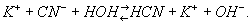
Раствор соли сильной кислоты и слабого основания, например NH4Cl, — кислый

Если заряд катиона (или аниона) соли больше единицы, то гидролиз часто приводит к образованию кислых (или основных) солей в качестве продуктов первой ступени процесса, например:
CuCl2 ® Cu (OH) Cl ® Cu (OH)2.
Количественной характеристикой гидролиза солей может служить степень гидролиза определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С a = 0,01%, а для ацетата аммония CH3COONH4 a = 0,5%. С повышением температуры и разбавлением раствора степень гидролиз увеличивается.
Гидролиз солей лежит в основе многих важных процессов в химической промышленности и лабораторной практике. Частичный гидролиз трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент). Благодаря гидролизу возможно существование буферных систем, способных поддерживать постоянную кислотность среды. Такие растворы имеют и очень важное физиологическое значение — постоянная концентрация ионов Н+ необходима для нормальной жизнедеятельности организма. С гидролизом солей связан ряд геологических изменений земной коры и образование минералов, формирование природных вод и почв.
Гидролиз органических соединений — расщепление органического соединения водой с образованием двух или более веществ. Обычно гидролиз осуществляется в присутствии кислот (кислотный гидролиз) или щелочей (щелочной гидролиз). Гидролитическому расщеплению чаще всего подвергаются связи атома углерода с другими атомами (галогенами, кислородом, азотом и др.). Так, щелочной гидролиз галогенидов служит методом получения (в том числе и промышленного) спиртов и фенолов, например:
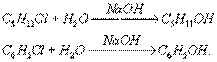
В зависимости от строения углеводородного радикала (R) и от условий реакции гидролиз галогенпроизводных может осуществляться как мономолекулярный (SN1) или бимолекулярный (SN2) процесс. В случае мономолекулярной реакции вначале происходит ионизация связи углерод — галоген, а затем образующийся ион карбоний реагирует с водой; щёлочь, если она добавлена, не влияет на скорость Гидролиз и служит только для нейтрализации выделяющейся галогеноводородной кислоты и смещения равновесия:
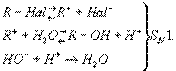
В случае бимолекулярной реакции скорость гидролиза прямо пропорциональна концентрации щёлочи:
R—Hal+ + HO- ® R—OH + Hal-SN2.
Исключительно важен гидролиз сложных эфиров (реакция, обратная этерификации):
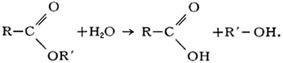
Кислотный гидролиз сложных эфиров является обратимым процессом:
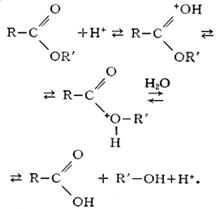
Щелочной гидролиз сложных эфиров необратим, поскольку он приводит к образованию спирта и соли кислоты:

Этот процесс широко применяется в промышленности для получения спиртов и кислот, например при омылении жиров с целью получения глицерина и солей высших алифатических кислот (мыла).
Аналогично сложным эфирам гидролизуются амиды кислот:

Случаи гидролиза углерод-углеродной связи сравнительно редки. К ним относятся, в частности, кетонное (действием кислот и разбавленных щелочей) и кислотное (действием концентрированной щёлочи) расщепление 1,3-дикарбонильных соединений, например ацетоуксусного эфира:

Термин «Гидролиз» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно было бы называть гидратацией
Гидролиз сложноэфирных, гликозидных (в углеводах) и амидных (в белках) связей играет огромную роль в жизнедеятельности любых организмов, например, в таких процессах, как усвоение пищи, передача нервных импульсов и т. п. Гидролиз в живом организме катализируется ферментами гидролазами.
|
|
Дата добавления: 2014-10-22; Просмотров: 1436; Нарушение авторских прав?; Мы поможем в написании вашей работы!