
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стерилізація посуду, інструментів і матеріалів
|
|
|
|
МЕТОДИКА ПРОВЕДЕННЯ ЛАБОРАТОРНИХ ДОСЛІДЖЕНЬ
Лабораторна робота №2.
КОНТРОЛЬНІ ПИТАННЯ
1. Назвіть методи для контролю за станом атмосфери.
2. Як правильно приготувати посуд для відбору проб води на аналіз?
3. Методи концентрування.
4. Якими методами усувають домішки з проб води?
5. Як правильно проводити відбір проби ґрунтів для аналізу?
Мета роботи – навчитися стерилізувати посуд, інструменти та матеріали; підготовлювати живильні середовища для лабораторних досліджень та ознайомитися з сучасними методами дослідження стану довкілля.
ТЕОРЕТИЧНА ЧАСТИНА
Стерилізацію проводять різними прийомами, вона є обов'язковою умовою для успішного виконання багатьох екологічних робіт. Найчастіше використовують хімічну і фізичну стерилізацію. Повне звільнення будь-якого матеріалу від живих мікроорганізмів та їх форм у стані спокою називається стерилізацією, або знеплідненням. В основі стерилізації є здатність певних факторів спричинювати загибель мікроорганізмів та їх спор. Агенти, що призводять до загибелі клітин мікробів, називають бактерицидними. Як стерилізуючі насамперед з них використовують ті, які не потрібно в подальшому виділяти з матеріалу, що обробляється. До таких агентів відносять високу температуру, променеву енергію, деякі леткі хімічні сполуки. Рідини можна звільнити від мікробів фільтруванням.
Стерилізація під дією високих температур. Найчастіше для стерилізації використовують високі температури, що призводять до загибелі клітин мікроорганізмів. Дія на мікроорганізминизьких температур (-190 в рідкому азоті чи -252 в рідкому кисні) не спричинює значних змін у їх клітинах. Ефективність бактерицидної дії температурного фактора залежить від ступеня нагрівання, тривалості впливу певної температури, виду мікроорганізмів, атакож складу середовища. Для знищення вегетативних форм більшості мікробів досить температури в межах 61,5 - 85,0°С і експозиції, відповідно, від 30 до 3 хв. Спори бактерій гинуть при температурі вище 100 °С. Слід пам'ятати, що при зниженні вологості стійкість бактерій та їх спор до високих температур збільшується. Так, в умовах вологого жару спори гинуть при 110 - 120 °С протягом 20 - 30 хв, а в умовах сухого жару - при 180 °С і експозиції 45 хв.
Мікроорганізми суттєво відрізняються за чутливістю до температури, що, мабуть, можна пояснити різною будовою оболонок їх клітин. Так, необоротні процеси в клітинах пневмококів починаються при температурі 45 - 50 °С, а стафілококів — при 60 - 70 °С. Тим часом ряд термофільних бактерій — Methanobacterium thermoautotrophum, Themoactinomyces vulgaris та інших — вегетують при температурі 60 - 70°С і навіть більше. Загибель мікроорганізмів під дією високих температур настає внаслідок денатурації білків клітини. Крім того високі температури порушують осмотичний бар'єр клітини, рівновагу ферментативних реакцій і т.д. Стерилізацію високими температурами можна здійснювати різними способами: пропалюванням у полум'ї горілки або вологим жаром насиченим паром під тиском (автоклавуванням).
Пропалюванням в полум’ї горілки стерилізують бактеріологічні петлі та голки, кінці пінцетів, пробочні свердла та деякі інші металічні прилади. У мікробіологічній практиці часто користуються мікробіологічною петлею для збору мікробного матеріалу. Бактеріологічну петлю виготовляють з платинового чи ніхромового дроту завдовжки 8 - 10 см, один кінець якого загнутий у вигляді кола, а інший закріплюється в спеціальному металевому тримачі.
Стерилізацію кип’ятінням проводять у стерилізаторі на слабкому вогні, щоб уникнути розбризкування рідини. Початком стерилізації вважають момент закипання води у стерилізаторі. При закінченні кип’ятіння воду зливають, а інструменти беруть стерильним пінцетом. Кип’ятінням стерилізують різноманітні шприци, металічні інструменти (ножиці, скальпелі, пінцети), гумові рукавички та пробки, деякі інші предмети, інструменти, що містять металеві частини, стерилізують у 2%-му розчині гідрокарбонату натрію, що попереджує ржавіння.
Пастеризація (неповна стерилізація). Забезпечує знищення лише вегетативних клітин мікроорганізмів. Для цього достатньою є температура 75 - 800С протягом 5 - 10 хв. найчастіше пастеризують продукти харчування (молоко, соки, ягоди, фрукти, вина і т.д.), які при вищих температурах втрачають свої якості. При пастеризації гинуть спори грибів, вегетативні клітини бактерій, зокрема патогенних, проте бактеріальні сидоспори залишаються життєздатними. Їх проростанню при зберіганні протидіють низькі рН, високі концентрації цукру, відсутність кисню та деякі інші фактори.
Стерилізацію сухим жаром здійснюють в сушильних шафах. Найчастіше в лабораторіях використовують електричну сушильну шафу, що складається з корпусу, де знаходиться циліндрична робоча камера. В камері розташовані зйомні робочі полички. Шафа обігрівається за допомогою дроту для нагрівання, намотаному на термостійку пластинку, яка знаходиться на зовнішній стінці камери. Простір між стінками корпусу і робочою камерою заповнений термоізоляційним матеріалом. У шафу вмонтовано термометр. Обігрівання регулюють за допомогою автоматичного терморегулятора. Максимальна температура в сушильній шафі становить 2000С. Гарячим повітрям у сушильній шафі передусім стерилізують скляний посуд (пробірки, воронки, піпетки, стакани, конічні колби і т.д.). Перед стерилізацією посуд ретельно миють та сушать. При стерилізації спори бактерій переносять високу температуру протягом тривалого часу.
Звичайна тривалість стерилізації при температурі 1600С – 2 години, при 1800С – 40 хв., а при 2000С – 10-15 хв. слід мати на увазі, що при температурі 1700С папір і вата жовтіють, а при вищих температурах обвуглюються. При закінченні стерилізації сушильну шафу вимикають, але її двері не відчиняють до повного охолодження, оскільки холодне повітря, що надходить до шафи може призвести до розтріскування гарячого посуду.
Стерилізацію вологим жаром проводять в апараті Коха чи автоклаві при відкритому випускному крані. Апарат Коха – це порожній металевий циліндр з подвійним дном та з електронагріваючим пристроєм. Простір між верхньою та нижньою пластинками дна заповнюють водою на 2/3. У кришці апарату є термометр та отвір для виходу пару. В апараті Коха стерилізують переважно живильні середовища, властивості яких змінюються при температурах вищих 1000С. Матеріал обробляють проточним паром для проведення поетапної стерилізації. При цьому матеріал, найчастіше живильні середовища, підлягає три- або чотирьохкратній обробці вологим жаром протягом 1 години при температурі 56 - 750С з інтервалом 24 години, протягом яких підтримується температура, сприятлива для проростання спор. Вегетативні клітини, які проросли зі спор, швидко гинуть при наступному нагріванні матеріалу.
Стерилізація вологим паром під тиском (автоклавування) базується на прогріванні будь-якого матеріалу насиченим паром при тиску, вищому за атмосферний. Відомо, що температура насиченого пару залежить від тиску - з підвищенням тиску його температура збільшується. Оскільки з підвищенням тиску температура кипіння рідин підвищується, то з'являється можливість стерилізувати їх при 100 °С та вище, не допускаючи кипіння, і, відповідно, випаровування та розбризкування. Тривалість автоклавування залежить від хімічного складу матеріалу, що стерилізується, виду мікробів, що знаходяться в ньому, а також об'єму (теплоємності) посудин, де проводять стерилізацію. Умови підвищеного тиску насиченої пари створюють у спеціальних товстостінних апаратах, що герметично закриваються, — автоклавах. Вони бувають різної конструкції, але принципова схема їх однакова (рис. 2).
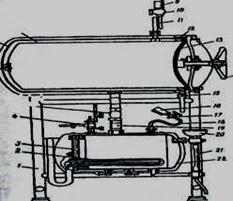
|
Рис. 2. Принципова схема горизонтального автоклава: 1 — постамент; 2 — нагрівальний елемент; 3 — кришка котла; 4 — запобіжний клапан; 5 — вентиль; 6 — кожух; 7 — парова камера; 8 — стерилізаційна камера; 9 — манометр парової камери; 10 — трьохходовий кран; 11 — сифонна трубка парової камери; 12 — опорне кільце; 13 — кришка парової камери; 14 — штурвал; 15 — спускний кран; 16 — манометр котла; 17 — трьохходовий кран котла; 18 — сифонна трубка котла; 19 — патрубок; 20 — воронка; 21 — повітрявказуююча воронка; 22 — котел.
Дві камери — велика (робоча) та маленька (водопарова) з'єднані між собою трубопроводом з вентилем. Водопарова камера з'єднується також із зовнішнім середовищем трубкою з водомірним склом, краном та воронкою, через яку її наповнюють дистильованою водою. Робоча камера, куди вміщують матеріал, що стерилізується, має кран для виходу повітря, манометр для визначення тиску пари та запобіжний клапан для виходу пари при занадто високому тиску.
Воду у водопаровій камері нагрівають за допомогою вмонтованих електродів та регулюються автоматично. Початком стерилізації вважають той момент, коли стрілка манометра показує заданий тиск. Тиск підтримують регулюванням підігрівання. Коли стерилізація закінчується, нагріванняприпиняють. Слід дочекатися, коли тиск в автоклаві зрівняється з атмосферним. Потім відкривають кран, що виводить пару. Лише після зниження тиску до нуля і виходу пари повільно відкривають кришку автоклава. До роботи з автоклавом допускають лише осіб, що пройшли спеціальне навчання.
Перевірка ефективності теплової стерилізації. Оскільки при автоклавуванні бактерицидний вплив справляють високі температури і насичена пара, а в більшість автоклавів (з міркувань простоти та безпеки) вмонтовано лише манометри, кожного разу виникає потреба впевнитися в тому, що матеріал підлягав дії стерилізуючої температури протягом достатнього часу. Температуру в автоклавах контролюють за допомогою спеціальних термоіндикаторів — термочутливих фарб, що змінюють забарвлення внаслідок дії стерилізуючої температури, чи речовин(сірки, цукру), що плавляться лише при певних температурах.
Ефективність бактерицидноїдії високих температур контролюють, розміщуючи разом з матеріалом, що підлягає стерилізації, смужки паперу, на які нанесено спори стійких до нагрівання бактерій, наприклад, Bacillus subtilus або ампули, що містять спори В. stearorfiennophitus, які відносять до найбільш термостійких. Після закінчення стерилізації смужки паперу або ампули вміщують в умови, сприятливі для проростання спор.
Стерилізація фільтруванням. Багато компонентів рідких живильних середовищ термолабільні і швидко руйнуються під дією високих температур. Тому рідкі живильні середовища та інші рідкі матеріали зручніше (значно швидше та ефективніше, ніж у разі дрібної стерилізації) стерилізувати фільтруванням. Вперше стерилізацію рідин фільтруванням використав Шамберлан, учень Пастера. Він виготовив фарфоровий фільтр, що представляв собою порожній циліндр, закритий з одного кінця та нагадував свічку, — "свічку Шамберлана". Фільтр затримує найдрібніші з усіх відомих бактерій. Для стерилізації питної води використовують фільтр Беркефільда — „ свічку Беркефільда". Стінки свічок Шамберлана і Беркефільда складаються з глинозему або фарфору. Ці матеріали мають позитивний електричний заряд, тимчасом як бактерії заряджені негативно. Таким чином, механізм фільтрації через свічки полягає не в їх "просіюючій" дії, а має адсорбуючий характер. До адсорбуючих відносяться також фільтри, виготовлені з глини, азбесту та деяких інших матеріалів. Пори цих фільтрів за розмірами більші від бактерій.
Зараз у мікробіологічній практиці широко застосовують азбестові та скляні фільтри. Азбестові фільтри є пластинками завтовшки 3-5 мм та діаметром 35 і 140 мм. Для стерилізації використовують фільтри марки "СФ" (стерилізуючий фільтр). Перед використанням азбестові пластинки монтують у спеціальний фільтрувальний апарат — прибор Зейтца, що складається з двох частин: металевого або скляного циліндра та нижньої частини з опорною сіткою. На опорну сітку вміщують азбестовий фільтр і обидві частини апарата з'єднують гвинтами чи зажимами. На трубку нижньої частини апарата одягають гумову пробку, через яку її вставляють у колбу Бунзена. Зібраний таким чином прибор Зейтца загортають у папір та стерилізують в автоклаві. Рідину, що підлягає стерилізації, наливають у циліндр і з'єднують бічне відгалуження колби Бунзена з вакуум-насосом. Внаслідок різниці пісків рідина проходить через азбестовий фільтр у приймач (колбу). В апарат Зейтца можуть монтуватися також стерилізуючі скляні та мембранні фільтри.
Мембранні фільтри виготовляють з ацетату целюлози або нітроцелюлози. Фільтри з нітроцелюлози є щільним переплетенням нітроцелюлозних волокон. Метод їх виготовлення дозволяє контролювати максимальний розмір частинок, що проходять через фільтр. Пори фільтру мають неправильну форму і становлять приблизно 80%його площі. Діапазон максимальних розмірів частинок, що затримуються, в залежності від номера фільтра може варіювати від 0,01 до 8,0 мкм. Бактеріальні нітроцелюлозні фільтри, що виготовлялися в колишньому СРСР, були дисками білого кольору діаметром 35 мм і товщиною 0,1 мм. Залежно від величини пор вони позначаютьсяпорядковими номерами від 1 до 5. Через малий розмір пор та високий поверхневий натяг, що виникає при контакті з поверхнею, з нітроцелюлозними фільтрами працюють, використовуючи тиск або розрідження. Щоб зменшити гідрофобність фільтрів, у них вводять детергент (поверхнево-активну речовину), а для попередження висихання обробляють гліцерином.
Безпосередньо перед застосуванням мембранні фільтри стерилізують кип'ятінням, їх вміщують у дистильовану воду, підігріту до температури 50-60°С та, щоб уникнути скручування, кип'ятять на слабкому вогні протягом 30 хв, двічі-тричі змінюючи воду. При цьому з пластинки фільтру змивається гліцерин. Для попередження пошкодження стерильні фільтри із стерилізатора виймають фламбованим (стерильним) охолодженим пінцетом з гладенькими кінцями. Мембранні пластинки, як і азбестові, монтуються у спеціальні фільтрувальні апарати, зокрема й апарат Зейтца.
Зараз для стерилізації застосовують також молекулярні фільтри, які відділяють малі макромолекули від великих і ефективно затримують вірусні часточки. Як і молекулярні фільтри використовують мембрани "Діафло" або "Пелікон", що виготовляють американські фірми, а також вітчизняні ядерні фільтри (ядерні сита). Останні є тонкими (0,1-1,0 мкм) лавсановими плівками з каліброваними важкими йонами отворами, розміри яких варіюють від 2 до 100 А. Плівки кріпляться на товстішому (50-250 мкм) підтримуючому шарі з губчастою структурою. Діапазон молекулярних мас молекул, що проходять через фільтр, варіює від 500 до 100 тис. дальтон.
Стерилізація опромінюванням. На клітини бактерій летальний ефект справляють ультрафіолетові, рентгенівські, α-,β-,γ-промені та нейтрони. В лабораторних умовах здебільшого використовують ультрафіолетові промені, джерелом яких є спеціальні бактерицидні лампи. Випромінювачем у них є електрична дуга, що виникає в парах ртуті низького тиску та випромінює лінійний спектр в ультрафіолетовій ділянці, понад 80% якого припадає на довжину хвилі 253,7 нм. Бактерицидні лампи використовують для часткової дезинфекції відкритих поверхонь та повітря приміщень (операційні, хірургічні відділення, пологові будинки, бокси тощо). Застосування ультрафіолету обмежене через його малу проникаючу здатність. Вегетативні форми бактерій більш чутливі до стерилізації, аніж спори, які в 3-10 раз стійкіші. Слід пам'ятати, що ультрафіолетові промені спричиняють гостре запалення рогівки ока. Тому треба стежити, щоб ані прямі, ані відбиті промені не потрапляли на око, та застосовувати захисні окуляри.
Хімічна стерилізація (дезинфекція). Дезинфекція є видаленням або руйнуванням патогенних мікроорганізмів, що находяться на неживих об'єктах чи поверхнях, за допомогою хімічних агентів, які називають дезинфікуючими речовинами. Дезинфікацію проводять тоді, коли неможливо застосувати стерилізацію паром чи іншими фізичними методами, — наприклад, коли мають справу з великими просторами, великими поверхнями та стаціонарним обладнанням.
Бактерицидна дія хімічних агентів обумовлена активністю функціональних груп, концентрацією активного компонента певної речовини, тривалістю контакту, рН, температурою, вологістю та наявністю органічної речовини. Як дезінфікуючі агенти застосовують галогени, фенол та їх похідні, сполуки важких металів, спирти, мікробоцидні гази та ін.
Галогени та їх похідні. При хімічній стерилізації здебільшого використовують хлор, йод та їх похідні. Як основу хлорних дезинфікуючих речовин використовують і гіпохлорит натрію. Широко застосовують хлораміни. Їх отримують, заміщаючи хлором водень амілових або імінових груп. У лабораторних умовах широко використовують і спиртовий розчин(настойку) йодуабо його похідне (йодофор-вескодин). Хлор та йод активні проти всіх бактерій та їх форм у стані спокою — спор. Оскільки вони активно з'єднуються з білком, то за його присутності їх слід брати в надлишку. При роботі зі сполуками хлору та йоду потрібно пам'ятати, що вони мають тенденцію виділятися з розчинів, надають їм неприємного запаху та є отруйними для живих тканин.
Для дезинфекції можна використовувати сполуки важких металів — ртуті, срібла, міді. Проте, оскільки препарати з ртуті (хлорид ртуті (II), оксиціанід ртуті) токсичні, а срібла — дорогі і мають переважно бактеріостатичну, а не бактерицидну дію, їх не рекомендують використовувати для дезинфекції.
Фенольні сполуки, наприклад о-фенілфенол, ефективніпроти вегетативних клітин бактерій у великих розведеннях і практично не мають запаху. Фенол справляє і дезинфікуючу дію на вегетативні клітини і спори бактерій, проте через неприємний запах його рідко застосовують. Фенольні сполуки неефективні проти бактеріальних спор.
Спирти, як і феноли, містять гідроксильні групи, які надають їм бактерицидні властивості. Для дезинфекції використовують тільки етиловий та ізопропіловий спирти, їх дезинфікуючівластивості приблизно однакові та збільшуються пропорційно концентрації від 50 до 70%. При вищих концентраціях бактерицидна дія спиртів різко знижується. Абсолютний етиловий спирт майже не має летальної дії на клітини бактерій. Спирти не викликають загибелі спор і мають повільну знезаражуючу дію.
Мікробоцидні гази. В останні роки встановлено здатність деяких газів знищувати вегетативні клітини та спори бактерій. До стерилізуючих газів відносяться формальдегід, окис етилену та пропіолактон. Формальдегід має виражену спороцидну активність. Максимальний стерилізуючий ефект досягається при відносній вологості 70% та температурі 22 °С. При низьких температурах формальдегід втрачає дезінфікуючу активність. До його недоліків слід віднести гострий, подразнюючий запах та здатність утворювати на поверхні органічного матеріалу, що стерилізувався, шар звернутої речовини, який захищає мікроорганізми під ним. Окис етилену використовують для дезинфекції у вигляді газової суміші, де на його долю припадає від 2 до 50%, іншим компонентом суміші є азот або вуглекислота. Окис етилену ефективно знищує вегетативні клітини та спори бактерій, але не справляє шкідливого впливу на різноманітні органічні матеріали, що легко пошкоджуються при нагріванніЙого застосовують для стерилізації поживних середовищ, що містять термолабільні елементи, пластмасових чашок Петрі та інших предметів, що плавляться при температурі вище 100 0С. Оскільки окис етилену не лише токсичний, а й леткий (температура кипіння -10,7 °С), його можна легко видалити з об'єктів шляхом короткочасного нагріваннядо 37 °С.
Слід пам’ятати, що окис етилену не стійкий і розпадається у водних розчинах, утворюючи етиленгліколь, що може призводити до небажаних ефектів. Крім того, окис етилену вибухонебезпечний та токсичний для людини.
β-пропіолактон при температурі 20 °С є рідиною зі солодкуватим подразнюючим запахом. У водних розчинах нестійкий. Ця сполука викликає загибель більшості мікроорганізмів та їх спор. Її дія обумовлена зв'язуванням з білками, жирними кислотами та вуглеводами клітини. β -пропіолактон застосовують для стерилізації термолабільних поживних середовищ, вакцин, сироваток та інших нестійких біологічних матеріалів. Звичайно у відповідне середовище додають 0,2% рідкого β -пропіолактону і витримують при 25 °С протягом 2-3 год. Протягом наступних кілька годин β -пропіолактон, що знаходиться в середовищі, повністю розпадається. Різні предмети та приміщення слід обробляти β -пропіолактоном в умовах відносної вологості 70-80% та концентрації його в повітрі 2-4 мг/мл. β -пропіолактон має подразнюючі та канцерогенні властивості, тому при роботі з ним необхідно дотримуватися відповідних застережливих заходів для попередження попадання його в середину організму.
Підготовка живильних середовищ для лабораторних досліджень.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 7589; Нарушение авторских прав?; Мы поможем в написании вашей работы!