
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Енергія Гіббса та напрямок перебігу хімічних процесів
|
|
|
|
На перебіг хімічного процесу можуть впливати два фактори: ентальпійний та ентропійний. Оскільки кожна система намагається перейти у стан із найменшим запасом енергії, самовільний перебіг будь-якого процесу має супроводжуватись зменшенням ентальпії системи. Однак кожна система намагається перейти з більш упорядкованого у менш упорядкований стан, що супроводжується збільшенням ентропії. Тобто ентальпійний та ентропійний фактори протилежні за характером. З огляду на це можливість перебігу хімічного процесу визначається енергією Гіббса ( Δ G), яка враховує обидва фактори:

Ентальпія або теплоємність системи при ізобарному процесі відповідає тепловому ефекту ( Δ Н) хімічної реакції.
Задача 1. Чому дорівнює зміна внутрішньої енергії Δ U при випаровуванні 100 г води при 20° С, якщо не враховувати зміну об'єму рідини та вважати, що водяна пара є ідеальним газом? Питома теплота пароутворення води q = 2445 Дж/г.
Розв'язання:
Для ізобарного процесу зміна внутрішньої енергії дорівнює:
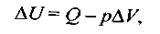
де: U - зміна внутрішньої енергії; Q - теплота реакції; р - тиск водяної пари; Δ V— зміна об'єму водяної пари.
Теплоту реакції можна розрахувати за формулою:
Q = q*m = 2,445 кДж/г • 100 г = 244,5 кДж.
При сталій температурі р Δ V = Δ U, тому, враховуючи рівнянняМенделєєва-Клапейрона

отримаємо 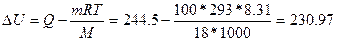
Відповідь: 230, 97 кДж.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 594; Нарушение авторских прав?; Мы поможем в написании вашей работы!