
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение спектра атома водорода, натрия
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА № 10
КРАТКАЯ ТЕОРИЯ
Целью настоящей работы является ознакомление со спектром водорода и натрия. В процессе её выполнения необходимо визуально наблюдать видимую часть спектра, измерить длины волн и по результатам этих измерений определить постоянную Ридберга.
Спектр излучения атома водорода состоит из отдельных резких линий и выделяется своей простотой. Ещё Бальмер (1885 г.), Ридберг (1890 г.) и Ритц (1908 г.) установили эмпирически, что спектральные линии водорода могут быть сгруппированы по сериям, причем длины волн выражаются с высокой точностью формулой:
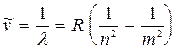 , (1)
, (1)
где 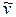 - волновое число; l -длина волны, в вакууме; R = 109677,581см-1 - постоянная Ридберга; n = 1, 2, 3,...- натуральное число, постоянное для линий данной серии, которое может рассматриваться как номер серии; m = n + 1, n + 2, n + 3,... - натуральное число, "нумерующее" линии данной серии.
- волновое число; l -длина волны, в вакууме; R = 109677,581см-1 - постоянная Ридберга; n = 1, 2, 3,...- натуральное число, постоянное для линий данной серии, которое может рассматриваться как номер серии; m = n + 1, n + 2, n + 3,... - натуральное число, "нумерующее" линии данной серии.
Серия с n = 1 (серия Лаймана) целиком лежит в ультрафиолетовой части спектра. Серия, соответствующая n = 2 (серия Бальмера) имеет первые четыре линии в видимой области. Серии с n = 3 (Пашена), n = 4 (Брекетта), n = 5 (Пфунда) и так далее находятся в инфракрасном диапазоне.
Спектроскопия высокой разрешающей силы показывает, что сериальные линии (I) обладают тонкой структурой; каждая линия состоит из нескольких близко расположенных составляющих на расстоянии сотых долей ангстрема для видимой части спектра.
Теория Бора. Многочисленные попытки объяснить линейчатую структуру атомных спектров, в частности формулу (1), с точки зрения классической физики оказались безуспешными. В 1911 г. опыты Резерфорда установили ядерную модель атома, которая с точки зрения классической механики должна рассматриваться как совокупность электронов, движущихся вокруг ядра. По законам классической электродинамики такая модель атома неустойчива, так как вследствие ускорения, необходимого для криволинейного движения по орбитам, электроны должны излучать энергию в виде электромагнитных волн и вследствие этого быстро упасть на ядро. В 1913 г. Бор, отказавшись от классических представлений, построил теорию, совместимую с ядерной моделью атома и объяснявшую основные закономерности в спектре атома водорода и сходных с ним атомных систем.
Теория Бора основана на следующих допущениях-постулатах:
1. Атомная система имеет дискретные устойчивые стационарные состояния с определенной энергией, которые можно рассматривать с помощью обычной механики, но в которых система не излучает, даже если она должна излучать по классической электродинамике.
2. Излучение происходит при переходе из одного стационарного состояния в другое в виде кванта энергии hv монохроматического света (здесь v – частота излучения; h = 6,62 10-27 эрг.сек - постоянная Планка).
3. В специальном случае движения по круговым орбитам стационарными являются только те орбиты, на которых момент количества движения P электрона кратен величине h/2p:
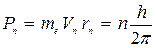 , (2)
, (2)
где n = 1, 2, 3,...; me - масса электрона, rn - радиус n -й орбиты; Vn - скорость электрона на n -й орбите.
В соответствии с законом сохранения энергии и первыми двумя постулатами Бора энергия кванта излучения при переходе между стационарными состояниями с энергиями E' и E'' равна
hv= E' - E''. (3)
Если сравнивать формулы (1) и (3), то легко увидеть, что энергия стационарных состояний атома водорода принимает, с точностью до знака дискретный квантовый ряд значений:
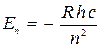 , (4)
, (4)
где c - скорость света.
Рассмотрим атом, состоящий из ядра с зарядом Ze и одного электрона. Для водорода Z = 1, для однократно ионизированного гелия (He+) Z = 2, для дважды ионизированного лития (Li++) Z = 3 и т.д. Сила кулоновского взаимодействия между ядром и электроном будет равна:
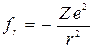 , (5)
, (5)
где r - расстояние между ядром и электроном. Под влиянием этой силы электрон движется вокруг ядра по эллиптической орбите, в частности, по окружности. Если отсчитывать потенциальную энергию U от её значения для бесконечно удаленного электрона, то
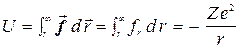 . (6)
. (6)
При движении по окружности центростремительная сила равна
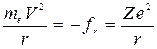 , (7)
, (7)
откуда кинетическая энергия
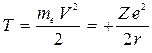 . (8)
. (8)
Полная энергия
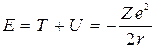 . (9)
. (9)
Из соотношений (2) и (7) находим для радиуса круговой стационарной орбиты
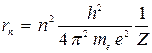 . (10)
. (10)
Равенство (10) показывает, что стационарные орбиты представляют собой окружности, радиусы которых растут пропорционально квадрату номера орбиты.
Подставляя (10) в (9), получаем энергию в стационарных состояниях (рис. 2):
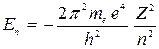 . (11)
. (11)
Выражение (11) совпадает с (4), если положить
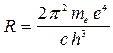 . (12)
. (12)
Величина (12) несколько отличается от значения постоянной Ридберга, найденной из спектроскопических измерений. Дело в том, что при выводе формулы (11) мы предполагали ядро неподвижным, тогда как в силу конечности своей массы оно вместе с электроном движется вокруг их общего центра инерции. Чтобы учесть это обстоятельство, достаточно вместо массы электрона ввести приведенную массу электрона и ядра:
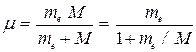 , (13)
, (13)
где M - масса ядра.
Заменяя в (12) me на m, получаем в случае атома водорода (M = Mp):
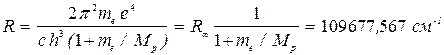 , (14)
, (14)
что прекрасно согласуется с экспериментом. Здесь R соответствует бесконечно большой массе ядра и совпадает с (12).
Выражение (14) показывает, что постоянная Ридберга для изотопов водорода (дейтерия с Мд = 2Мp и трития МТ = 3Мp), вследствие различия в приведённых массах, отличается от постоянной Ридберга Rp для легкого водорода. Это хорошо согласуется с наблюдаемым сдвигом линий в спектрах дейтерия и трития по сравнению со спектром водорода (изотопический сдвиг).
Для описания более тонких эффектов, например расщепления спектральных линий, излучаемых атомами во внешнем поле, недостаточно рассмотрения только круговых орбит. Более общие условия стационарности, чем (2), пригодные для эллиптических орбит, были даны Зоммерфельдом в следующем виде: если механическая система с i -ми степенями свободы описывается обобщенными координатами qi и соответствующими обобщенными импульсами pi = ¶T/¶qi, то стационарны только те состояния системы, для которых
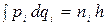 , (15)
, (15)
где ni - целые квантовые числа, а интегрирование распространяется на всю область изменения qi. В случае эллипса, описываемого полярными координатами r и j, имеем
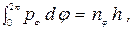 (16)
(16)
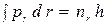 , (17)
, (17)
где nj и nr - азимутальное и радиальное квантовые числа. В силу постоянства момента количества движения pj = const = p условие (16) дает, как и в случае круговой орбиты,
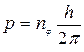 . (18)
. (18)
Соответствующий расчет показывает, что энергия электрона зависит от суммы nj +nr = n по формуле (11). n называют главным квантовым числом. Так как nj = 1, 2,... n, при заданном n, имеется n эллиптических орбит с одинаковой энергией (11) и с различной величиной момента количества движения (18). Если рассмотреть третью степень свободы, то условие квантования (15) для неё приводит к тому, что каждая орбита может быть сориентирована в пространстве не произвольным образом, а лишь так, что проекция момента количества движения на любое фиксированное направление OZ может принимать 2 n + 1 значений, кратных h/(2p):
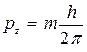 , (19)
, (19)
m = - nj, - nj + 1 ,..... nj - 1, nj. (20)
Теория Бора – Зоммерфельда с полной отчетливостью показала неприменимость классической физики и первенствующее значение квантовых законов для микроскопических систем. Она объяснила основные закономерности в спектрах водородоподобных ионов, щелочных металлов, рентгеновских спектрах. В её рамках впервые получили объяснения закономерности периодической системы элементов. С другой стороны, теория не дала последовательного объяснения интенсивности и поляризации спектральных линий. Никак не удались попытки построить теорию простейшей двухэлектронной системы - атома гелия. Недостатки теории Бора являются следствием её внутренней противоречивости. Действительно, с одной стороны, она привлекает чуждые классической физике идеи квантования, а с другой - пользуется для описания стационарных состояний классической механикой. Наиболее правильную картину внутриатомных физических явлений дала последовательная квантовая теория - квантовая механика, по отношению к которой теория Бора явилась важнейшим переходным этапом.
Квантовомеханическое описание стационарных состояний. Основное отличие квантовой механики от теории Бора состоит в отказе от представления о движении электрона по классически определенной орбите. Применительно к микрочастице можно говорить не о её месте на траектории, а лишь о вероятности dW найти эту частицу в объеме dV, равной
dW = | Y (x, y, z)|2 dx dy dz, (21)
где Y (x, y, z) - волновая функция, подчиняющаяся уравнению движения квантовой механики. В простейшем случае уравнение, полученное Шредингером для стационарных состояний, имеет вид
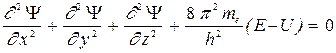 , (22)
, (22)
где E и U - полная и потенциальная энергии частицы с массой mе.
Вероятность пребывания электрона в единице объема Y |(x, y, z)|2, рассчитанная для каждой точки, создает представление об электронном облаке как о некотором статистическом распределении электронного заряда в пространстве. Каждое стационарное состояние характеризуется своим распределением электронной плотности, и переход из одного стационарного состояния в другое сопровождается изменением размеров и конфигурации электронного облака.
Плотность электронного облака является функцией расстояния от ядра r. Интересно отметить для сравнения с теорией Бора, что максимум радиальной плотности основного состояния атома водорода соответствует точке r, определяемой по формуле (10), т. е. наибольшее вероятное расстояние электрона от ядра в точности равно радиусу первой орбиты в теории Бора (рис. 1).
С увеличением размера электронного облака, как правило, увеличивается его энергия En, характеризуемая главным квантовым числом n. Формой электронного облака определяется "орбитальный" момент количества движения рl, характеризуемый квантовым числом l.
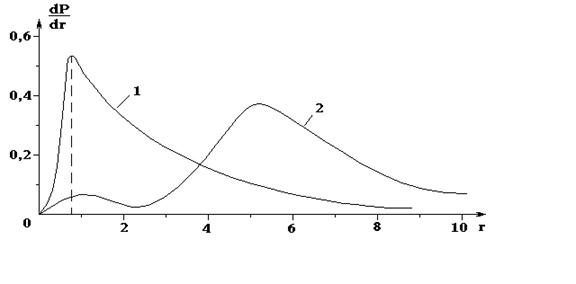
Рис. 1. Распределение вероятностей для электрона в состояниях:
1 - n = 1, l = 0 и 2 - n = 2, l = 0
Ориентация облака определяет проекцию момента рlz в пространстве, характеризуемую квантовым числом ml. Кроме орбитального момента, электрон имеет собственный момент количества движения - спин рs, который может иметь в пространстве две ориентации, что характеризуется двумя значениями квантового числа ms = - 1/2, + 1/2. Можно представить себе, что спиновый момент обусловлен вращением электрона вокруг своей оси (подобно тому, как вращается вокруг своей оси Земля, двигаясь по орбите вокруг Солнца). Эта простая картина удобна как наглядное геометрическое представление возможного происхождения спина. Строгое определение спина может дать только квантовая теория.
Согласно квантовой механике моменты количества движения и их проекции определяются следующими соотношениями:
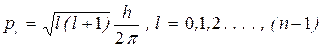 , (23)
, (23)
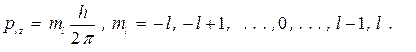 (24)
(24)
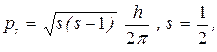 (25)
(25)
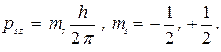 (26)
(26)
Заметим, что правила квантования (18), (19) Бора – Зоммерфельда являются приближением к (23), (24) при больших l.
Таким образом, чтобы однозначно определить состояние электрона в атоме, можно задать четыре физические величины En, pl, plz, psl, или, что то же самое, четверку квантовых чисел m, l, ml, ms. Значения этих квантовых чисел ограничены формулами (23) - (26).
n = 1, 2, 3, 4,...; (27)
l = 1, 2, 3, 4,..., n - 1; ml = - l, - l + 1,..., 0,..., l - 1, l;
ms = -1/2, +1/2.
Орбитальное число l = 0, 1, 2, 3, 4 и т.д. принято обозначать буквами s, p, d, f, q и далее по алфавиту.
Путем изменения четверки квантовых чисел можно получить всевозможные состояния атома. Последовательность заполнения этих электронных состояний определяется двумя принципами: принципом Паули и принципом наименьшей энергии.
Согласно принципу Паули, атом не может иметь двух электронов, обладающих одним и тем же набором квантовых чисел. По принципу наименьшей энергии заполнение электронных состояний происходит от низких значений энергии к высшим в последовательности
1 s < 2 s < 2 p < 3 s < 3 p. (28)
В соответствии с принципом Паули и ограничениями (27) в состояниях с заданными n и l не может находиться более чем 2(2 l + 1) электронов. Поэтому в s -состоянии (l = 0) может находиться не более двух электронов, в p -состоянии (l = 1) – не более шести электронов и так далее. В состоянии с данным квантовым главным числом n может находиться не более 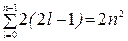 электронов.
электронов.
Совокупность состояний с заданным n называется электронной оболочкой, совокупность состояний с заданной парой чисел n и l называется подоболочкой. Распределение электронов в атоме по подоболочкам называется электронной конфигурацией. Например, электронные конфигурации основных состояний атомов водорода, лития, гелия, натрия и т.д. имеют вид:
1 s 1 (H)
1 s 2 (He)
1 s 2 2 s 1 (Li)
1 s 2 2 s 2 2 p 6 3 s 1 (Na),
где верхние индексы указывают число электронов в соответствующих подоболочках, а цифры, стоящие в ряду, - значение главного квантового числа n. Поясним правило написания электронных конфигураций на примере атома натрия Z = 11. Зная максимальное число электронов в состояниях s и p (2 и 6 соответственно), разместим 11 электронов, следуя вдоль неравенства (28) слева направо, тогда получаем 1s2 2s2 2p6 3s1. Аналогичным образом получается электронная конфигурация других атомов.
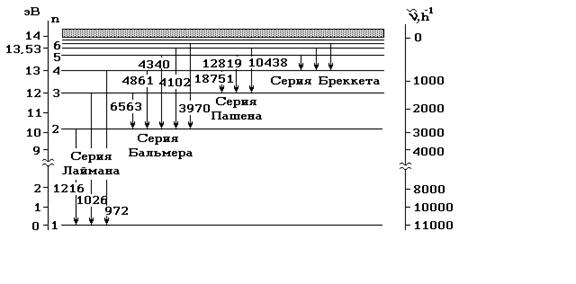
Рис. 2. Диаграмма энергетических уровней и излучательных переходов атома водорода
Таблица
Длины волн в спектре излучения ртути
| Цвет | Желтый | Зеленый | Голубой | Синий | Фиолетовый | ||||
| номер | I | II | I | I | I | II | III | I | II |
| длина волны А |
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Включить блок питания монохроматора УМ-2 и ртутную лампу.
2. Пользуясь таблицей, провести градуировку монохроматора (построить график).
3. Включить газоразрядную трубку с натрием и определить длины волн в видимой части спектра, пользуясь графиком.
4. Определить постоянную Ридберга для каждой линии и найти среднее значение.
5. Определить потенциал ионизации атома натрия.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1. Расскажите о теории строения атома, созданной Бором.
2. Чем отличается теория Бора от квантовомеханической теории?
3. Какие вы знаете квантовые числа? В чем состоит принцип Паули?
4. Напишите уравнение Шредингера для водородоподобного атома.
5. Как определяется спектроскопический заряд электрона?
6. Что представляет собой обобщенная формула Бальмера?
7. Поясните диаграммы энергетических уровней и излучательных переходов атома водорода и натрия.
Литература
1. Жеребцов И.П. Основы электроники. Ленинград, 1990.
2. Кошкин Н.И., Ширкевич М.Г. Справочник по элементарной физике. –М., 1988.
3. Мирдель К. Электрофизика. – М. 1972
4. Оптика и атомная физика: Лабораторный практикум по физике / Под ред. Р.И. Солоухина. 1976.
5. Пестров Э.Г., Лапшин Г.М. Квантовая электроника. –М. 1988.
6. Практикум по спектроскопии / Под ред. Л.В. Левшите, –М, 1976.
7. Савельев И.В. Курс общей физики. –М., Т.-2, 3., 1971.
8. Сивухин Д.В. Общий курс физики. Т-3, – М., 1990.
9. Трофимова Т.И. Курс физики. –М., Наука, 1990.
10. ФаноУ., Фано Л. Физика атомов и молекул. – М., 1980.
11. Шефтель И.Т. Терморезисторы. – М., 1972
12. Шпольский Э.В. Атомная физика. – М. 1990
13. Яворский Б.М., Селезнев Ю.А. Справочное руководство по физике. –М., 1989.
Учебное издание
Алексеев Вадим Петрович
Папорков Владимир Аркадьевич
Рыбникова Елена Владимировна
Лабораторный практикум
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2733; Нарушение авторских прав?; Мы поможем в написании вашей работы!