
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сыныбы: 8 сынып 2 страница
|
|
|
|
1-нұсқа: 1) S + O2 = x; 2-нұсқа: 1) x + H2O = H3PO4;
2) H2CO3 = H2O + x; 2) Na + x = Na2O;
3) MgCO3 = x + у; 3) Ca(OH)2 + x = CaCO3 + у;
№2 бақылау жұмысы. А,В,С деңгейлік тапсырмалары.
1-нұсқа.
1. Негіздерді жіктеуге екі мысалдан келтіріп, химиялық қасиеттерін сипаттаңдар.
2.Қышқылдарды жіктеп,әрқайсысына үш мысалдан келтіріп сипаттаңдар.
3.(Негіздік,қышқылдық,екідайлы оксидтердің әрқайсысына үш мысалдан келтіріңдер.
4.Тұздарды:NaCI,CaCO3,Ca(HCO3)2,MgOHCI,NaHCO3,K2CO3,Ca3(PO4)2 жіктеп жаз.
5.Төмендегі айналуларды іске асыруға болатын реакция теңдеулерін жаз:
Сa(OH)2 → CaCO3 → CO2 → Na2CO3;
↓
CaCI2
В6(2-балл). Төмендегі сызбанұсқаларға сәйкес химиялық реакциялардың теңдеулерін жазып теңестіріп,белгісіз заттарды тауып,оларды атаңдар: FeCI3 → x → Fe2O3 → у;
C7(4балл). Массасы 10г кальций карбонатын тұз қышқылымен әрекеттестіргенде бөлініп шығатын газды натрий сілтісі арқылы өткізгенде қанша грамм натрий гидрокарбонаты түзілетінін есептеңдер.
2-нұсқа.
А1(1-балл). Негіздерді жіктеуге екі мысалдан келтіріп,химиялық қасиеттерін сипаттаңдар.
А2(1-балл). Қышқылдарды жіктеп,әрқайсысына үш мысалдан келтіріп сипаттаңдар.
А3(1-балл). Негіздік,қышқылдық,екідайлы оксидтердің әрқайсысына үш мысалдан келтір.
А4(1-балл). Тұздарды:NaCI,CaCO3,Ca(HCO3)2,MgOHCI,NaHCO3,K2CO3,Ca3(PO4)2 жіктеп жазыңдар.
В5(2-балл). Төмендегі айналуларды іске асыруға болатын реакция теңдеулерін жаз:
CuCO3 → CuCI2 → Сu(OH)2 → CuO → Cu;
В6(2-балл). Төмендегі сызбанұсқаларға сәйкес химиялық реакциялардың теңдеулерін,жазып теңестіріп,белгісіз заттарды тауып,оларды атаңдар: CuCO3 → x → СuCI2  у;
у;
C7(4балл). Көлемі 4,48 л қалыпты жағдайда оттек түзілу үшін мына тұздардың: KNO3,,,,,,,,,,,,,,,,,,KCIO3,KMnO4 әрқайсысының қандай массалары қажет болатынын есептеңдер.
(Ескерту: Балдардың қосындысы жоғары болатындай қалаған төрт есепті шығарыңыз.)
Үйге тапсырма: §44-49 қайталау.
VI тарау. Д.И.Менделеев жасаған химиялық элементтердің периодтық заңы және
периодтық жүйесі.
№1-інші сабақ тақырыбы: Химиялық элементтерді жіктеудегі алғашқы қадамдар.
Оқыту мақсаты: Оқушыларға химиялық элементтерді жіктеудің қажеттілігін көрсету,элементтерді металдар және бейметалл деп үлкен екі топқа бөлген жіктеудегі алғашқы қадамдармен таныстырып,оның жасанды екенін,екідайлы және ауыспалы қасиет көрсететін элементтер туралы түсінік беру. Оларды элементтердегі табиғитекке біріктіру мақсатымен таныстыру.
Реактивтер мен құралдар: Жаңа дайындалған мырыш,натрий гидроксидінің және тұз қышқылының ерітінділері,сынауықтар,сынауық тұрғы.
Көрнекі тәжірибелер: Екідайлықты дәлелдеу.
Сабақ барысы: Ұйымдастыру кезеңі.
Жаңа сабақ: Сабақ тақырыптың маңызын айтудан басталады,одан соң әрбір ғылымның дамуына байланысты көптеген мәліметтер жинақталып, оны жіктеу,белгілі заңдылықтардың байланысын ашу қажеттілігі айтылады.
Химияда элементтер және олардың қосылыстары туралы білімнің жинақталуы ХІХ ғасырдың ортасында оларды ұқсас қасиеттеріне қарай топтастыруды қажет етті.Оқушыларға химиялық элементтерді жіктеудің негізгі белгілерін атап көсету.Элементтерді жіктеу негізінде физикалық және химиялық қасиеттерін нақтылауға мүмкіндік туа бастады. Нағыз металдарға негіздік оксидтер,оған негіздер сәйкес келеді.Ал нағыз бейметалдар ұшқыш сутекті қосылыстар түзеді,металдар ондай қосылыстар түзбейді.Содан кейін төмендегі эксперимент есептерді талдау:
1.Егер берілген зат суда ерімейтін болса,оның қышқыл екенін қалай дәлелдейміз? H2SiO3 –ұсыну.
2. Егер берілген зат суда ерімейтін болса,оның негіз екенін қалай дәлелдейміз? Сu(ОН)2-ұсыну.
Оқушылар төмендегідей қорытындыға келеді: а)нағыз металдың гидроксиді қыш- қылдармен әрекеттеседі,ал сілтімен әрекеттеспейді; ә)ал нағыз бейметалдан түзілген қышқыл сілтілермен әрекеттеседі,бірақ қышқылдармен әрекеттеспейді.
Кейбір элементтердің металға да,бейметалға да тән қасиет көрсетуіне қарай екідайлы қасиет көрсететіні белгілі болды.Оқушылардың алдында жаңа проблемалық сұрақ туады:,,,,,,,,,,,,,,,,,,,,,,,,,а)мырыш гидроксиді қышқыл болама,әлде негіз бола ма?
,,,,,,,,,,,,,,,,,,,,,,,,,ә) Мырыш нағыз металға жата ма, немесе нағыз бейметалға жата ма?
Оқушыларға көрнекі тәжірибе көрсетіледі. Мырыш гидроксидінің қышқылда да,сілтіде де еріп тұз түзетіні түсіндіріледі. Оқушылар мырыш ауыспалы қасиет көрсететін элемент деген қорытындыға келеді.Бұл қасиет металдан бейметалға ауысатын өтпелі элементке тән. Оқушылар мырыш гидроксидінің қышқылмен,негізбен әрекеттесуінің реакция теңдеулерін жазады.
Бұдан кейін оқушыларға қышқылдық та, негіздік те қасиет көрсететін гидроксидтер болатынын айта отырып,олардың негіздер мен қышқылдар туралы білімдерін қорытындылау мақсатында төмендегі кестені толтыруды ұсынамыз:
| Қосылыстар | |||
| негіздер | Екідайлы гидроксидтер | қышқылдар | |
| 1.Қышқылмен әрекеттесуі. 2.Негізбен әрекеттесуі. | + - | + + | - + |
Оқушыларға оксидтер немесе гидроксидтері екідайлы болатын элементтердің өте көп екендігін айтамыз. Мысалы: Be,Zn,AI,Cr(III),As,т.б.Осыдан кейін химиялық элементтерді жіктеу үшін жасалған басқа да әрекеттермен таныстырамын. Валенттігі бойынша бөлу:
а) жоғары оксидтегі валенттігі бойынша;
ә) ұшқыш сутекті қосылысындағы валенттігі бойынша;
Одан кейін төмендегі тапсырмалар беріледі:
1.BeO-нің екідайлы қасиетін көрсететін реакция теңдеуін құрастырыңдар.
2.Be(OH)2-нің екідайлы қасиетін көрсететін реакция теңдеуін құрастырыңдар.
3.Төмендегі айналымдардың теңдеулерін жазыңдар: Na2ZnO2
↑
ZnCI2→Zn→ZnO→Zn(OH)2→Zn(NO3)2
Үйге тапсырма: §50 (1-6). Жұмыс дәптері.
күні айы жылы
№2-інші сабақ тақырыбы: Элементтердің табиғи ұяластары және олардың қасиеттері.
Оқыту мақсаты: Элементтерді алғашқы топқа бөлу,ұқсастығы мен айырмашылығы арқылы оларды сілтілік металдар,галогендер,халькогендер және инертті газдарға топтастыру.Осы топтардағы элементтердің физикалық және химиялық қасиеттерінің салыстырмалы атомдық массаға тәуелді екенін түсіндіру.
Реактивтер мен құралдар: Сілтілік металдар,галогендер үлгілері,натрий,литий, су,стақан, сүзгі, индикатор, лабораториялық тұрғы, сіріңке.
Көрнекі тәжірибелер: Сілтілік металдар,галогендер үлгілері,cілтілердің сумен әрекеттесуі.
Сабақ барысы: 1.Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оқушыларға төмендегі сұрақтар қойылады:
1.Химиялық элементтерді жіктеудің негізгі себебі неде?
2.Химия ғылымы дамуының бастапқы сатысында химиялық элементтерді жіктеудегі алғашқы қадамдарды айт.
3.Zn(OH)2 –нің екідайлы қасиетін қалай дәлелдеуге болады? Тәжірибе жасау арқылы дәлелде.
4.Металдар мен бейметалдар оксидтерінің және екідайлы оксидтердің қандай қасиеттерін білесіңдер?
5.Бір оқушы тақтада элементтерді жіктеудің сызбанұсқасын сызып,оны түсіндіреді.содан кейін мына тапсырманы орындайды. №1 тапсырма.Мына өзгерістердің реакция теңдеулерін жаз:
BeO → Be(NO3)2 → Be(OH)2 → K2BeO2
Қалған оқушыларға екідайлы қасиет көрсететін оксидтер мен гидроксидтер туралы білімін бекіту үшін мына заттардың арасындағы реакция теңдеулерін жазуды ұсыну:
1-нұсқа. а) ZnO + HNO3; ә) ZnO + NaOH; 2-нұсқа. KAIO2 →AI(OH)3→ AI2O3→NaAIO2
б) Zn(OH)2 + H2SO4; в) Zn(OH)2 + KOH; ↓
AI(NO3)2
Жаңа сабақты әңгімелеуден бастау. Металдар,бейметалдар,ауыспалы элементтердің ішінде қасиеттері жағынан өте ұқсас элементтер кездеседі,сондықтан ерекше топқа біріктіру кажет болды. Мысалы,элементтерді төмендегі екі белгісі бойынша топқа біріктіру басталды: 1.Элементтердің оттекті қосылыстарындағы жоғары валенттігі;
2.Элементтердің ұшқыш сутекті қосылысындағы валенттігі;
1-топ.R2O; Li Na K Rb Cs ІІтоп.RO; Mg Ca Sr Ba ІІІтоп.R2O3 B AI IVтоп RO2 C Si Sn
7 23 39 86 133 24 40 88 137 11 27 12 28 119
Алайда, бұл бөлінген топтарға ХІХғасырдың ортасында табылған 63 элементтің барлығы бірдей кірген жоқ. Әрбір топтағы элементтер қалғандарымен салыстырғанда өзгеше, ол бір-біріне тек жоғарыда көрсетілген белгілері бойынша ғана емес,сол сияқты оксидінің құрамы,қасиеті,гидрок- сидтері,тұздары бойынша да өте ұқсас болды. Олар көбінесе табиғатта бірге кездеседі,қосылыс тардан бірдей әдістермен бөлініп алынады.Сол сияқты әрбір топқа кіретін элементтерді атомдық массасының өсуі бойынша орналастырғанда белгілі бір заңдылықтар байқалады:
а)жай заттардың металдық қасиеттері артады;
ә)оксидтері мен гидроксидтерінің негіздік қасиеттері артады;
б)ұшқыш сутекті қосылыстарының тұрақтылығы біртіндеп кемиді;
Көрсетілген топтарды табиғи тек деп атаудың басты себебі біріктірілген элементтер өте ұқсас. Осыдан кейін оқушыларды элементтердің табиғи ұяластарымен таныстырамын....
Тақырыпты қорытындылау үшін сілтілік металдардың және галогендердің табиғи топтарына
салыстырмалы сипаттама бере отырып,ұқсастығымен айырмашылығын ажыратуға үйрету.
Тапсырма: 1)Сілтілік металдар,галогендер,оттек және халькогендер тегіне жататын элемент- тердің физикалық және химиялық қасиеттеріндегі ұқсастықтары мен айырмашылықтарын көрсетіңдер.(кестелер бойынша:
2) С.а.м. өсуіне қарай физикалық қасиеттері қалай өзгереді?
3) Белсенділіктері қалай өзгереді?
4) С.а.м. өсуіне қарай химиялық қасиеттері қалай өзгереді?
Оқытудың жоспарланған нәтижесі: Оқушылар сілтілік металдар мен галогендердің физикалық қасиеттерін айтып,оларға тән химиялық қасиеттерін реакция теңдеулерін жазу арқылы дәлел- деуі қажет.
Дамытудың жоспарланған нәтижесі: Оқушылар сілтілік металдарды және галогендерді,инертті газдарды өзара салыстыра білуі тиіс.
Үйге тапсырма: §51 (1-6). Жұмыс дәптері.
күні айы жылы
№3-інші сабақ тақырыбы: Д.И.Менделеевтің периодтық заңы.
Оқыту мақсаты: Периодтық заңның мәнін,оның негізгі қағидаларын түсіну.Әрбір элементерге тән химиялық қасиеттерді талдай отырып, олар периодта орналасуына байланысты екенін түсіндіру. Элементтер және олардың қосылыстары жайлы мағлұмат алу алу үшін периодтық заңның маңызын түсіну қажеттігі.
Құрал – жабдықтары: Алғашқы 20 элементтің таңбасы жазылған қиықтар.
Сабақ барысы: Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оқушылар сабақтың барысында өздеріне таныс элемент терді жіктеудегі алғашқы қадамдарды естеріне түсіреді:
- Элементтерді екі топқа бөлу:металдар және бейметалдар.
- Үш класқа бөлу: металдар; екідайлы қосылыс түзетін элементтер;бейметалдар;
- Жалпы қасиеттеріне байланысты табиғи тектерге бөлу: салыстырмалы атомдық массалары және қосылыстардағы валенттіліктері.
Жаңа сабақ: Д.И.Менделеев химиялық элементтерді жіктеуді одан әрі жалғастырғанда, олардың салыстырмалы атомдық массасының өсу ретімен орналастыруды басшылыққа алған. Сонда элементтер қасиеттерінің белгілі бір элементтен кейін қайталанатынына көңіл аудар ғаны айтылады. Сөйтіп қасиеті ұқсас элементтерді бірінің астына бірін орналастыру нәтиже сінде табиғи топтар анықталған. Осыдан кейін оқушыларға Д.И.Менделеевтің жолын қайталау ұсынылады. (Ол үшін қиықтар қолданылады). Элементтердің қасиеттері атомдық массаның өсуіне қарай:
- элементтің сипаты:(металл,ауыспалы элемент,бейметалл);
- жоғары оксидтеріндегі валенттілігі;
- ұшқыш сутекті қосылыстарындағы валенттігі өзгеретініне көңіл аударамыз.
Оқушылар элементтердің қасиеті қосылыстардағы валенттілігі мен атомдық массасының өсуіне байланысты периодты түрде өзгереді деген қорытындыға келеді.Мұның өзі Д.И.Менделеев ке элементтерді салыстырмалы атомдық массаларының өсу реті бойынша орналастырып, периодтық заңды ашуға мүмкіндік берді. Осы заңдылықты 1869 жылы Д.И.Менделеев элемент тердің периодтық жүйесін жасағанда периодтық заң түрінде тұжырым дады.Қазіргі кездегі атом құрылысы теориясы тұрғысынан периодтық заңның ережесі: химиялық элементтің,олар түзетін жай заттарының және қосылыстарының қасиеті атом ядросының зарядына периодты түрде тәуелді болады.Оқушылар ережені талдай келе өздері оның маңызын түсінеді,дүниета -нымдылық көзқарастары қалыптасады.
Периодтық заң және периодтық жүйені ашуда Д.И.Менделеевтің еңбегі зор. Атомдық масса ның өсуін негізге ала отырып,кезінде Д.И.Менделеев болжаған элементтер кейін ашылды. Бұл сол кездегі атом және молекула туралы жаңа көзқарастың қалыптасуына жол ашты.
Сөйтіп, Д.И.Менделеев болжаған элементтердің толығымен ашылып, табиғатта кездесетін және жасанды жолмен алынған элементтердің бәрі периодтық жүйе де тиісті орын алғанын айту қажет. Элементтердің: металдық, бейметалдық қасиеттері, жоғары оксидтеріндегі валенттіктері, ұшқыш сутекті қосылыстарындағы валенттіктері, оксидтерінің қасиеттері, гидроксидтерінің қасиеттері былай өзгереді.
7Li 9Be 11B 12C 14N 16O 19F 20Ne Металдық қасиет кемиді, бейметалдығы артады
І ІІ ІІІ IV V валенттіліктері өседі
Li2O BeO B2O3 CO2 N2O5 - - -
Негіздік Екідайлы Қышқылдық оксидтер
LiOH Be(OH)2 H3BO3 H2CO3 HNO3 - - -
Негіз Екідайлы Өте әлсіз Әссіз Күшті
Гидроксид қышқыл қышқыл қышқыл
IV III II I валенттіліктері кемиді
CH4 NH3 H2O HF -
Сабақты бекіту үшін тапсырма беру. Na-ден Ar-ға дейінгі элементтердің: металдық, бейметал дық қасиет тері, жоғары оксидтеріндегі валенттіктері, ұшқыш сутекті қосылыстарындағы валенттіктері,оксидтерінің қасиеттері,гидроксидтерінің қасиеттері қалай өзгереді?
Оқытудың жоспарланған нәтижесі:Оқушылар Д.И.Менделеев ұсынған периодтық заңның ереже сін айтып,нақты мысалдар келтіре отырып, жеке-жеке элементке және оның қосылыстарына сипаттама бере білуі қажет.
Дамытудың жоспарланған нәтижесі. Окушылар элемент және оның қосылыстарының қасиет- терін период бойынша талдай білуге үйренеді.
Үйге тапсырма: §52. (1-7). Жұмыс дәптері.
күні айы жылы
№4-інші сабақ тақырыбы: Атом құрылысы. Атом ядросының құрамы, изотоптар.
Оқыту мақсаты: Атом құрылысы туралы білімді нақтылау. Химиялық элементтердің периодтық жүйедегі рет нөмірінің физикалық мәнін түсіндіру. Атом құрылысының күрделілігіне байланысты периодтық заңның қазіргі кездегі тұжырымдамасын айту.
Құрал – жабдықтары: Д.И.Менделеевтің периодтық жүйесі.
Сабақ барысы: Ұйымдастыру кезеңі.
Оқушылардың периодтық заң туралы білімін тексеру мақсатында тапсырмалар беру:
- Кейбір элементтердің сутегі мен және оттегімен қосылыстарының жалпы формулалары қандай:RH3,R2O,RO2,RH,RH4. Осылардың қайсысы көміртегі мен мышьяктың сутекпен қосылысы мен жоғары оксидінің формуласына сәйкес келеді?
- Мына қосылыстардың формуласы дұрыс болу үшін қажетті индекстерді қойыңдар: РН, Н, СН, NH.
- Жоғары оксидтерінің формуласы дұрыс болу үшін қажетті индекстерді қойыңдар: CIO, SbO, PbO, SiO.
Оқушыларға төмендегі сұрақтар қойылады:
- Салыстырмалы атомдық массаларының өсуіне қарай орналасқан элементтердің химиялық қасиеттері не себепті периодты өзгереді?
- Период дегеніміз не?
- Периодтық заңның тұжырымдамасы қандай?
- Неге кей жағдайларда (Ar–K, Co–Ni, Te–I) элементтер атомдық массаларының өсуіне байланысты орналаспаған?
5. Заңды өзгерістер болатын элементтердің және олардың атомдарының қандай қасиеттерін білесіңдер?
Осындай проблемалық сұрақтар кезінде Менделеевті де ойландырды. Өмірінің соңғы жылдарында мұның сыры атомдардың күрделі құрылысында болар деген болжам жасады. Оқушылар бұл сұраққа жауап беру үшін физикадан өткен атом құрылысы туралы білімдерін қолданады.
- Атом құрылысы туралы не білесіңдер?
- Атомдар қандай негізгі екі бөлшектен құралған?
Тағы басқа сұрақтар бере отырып, атомның күрделі құрылысы туралы әңгімелеу.
Оқушылардың жауабы 1911 жылы ағылшын физигі Резерфордтың атом ортасында оң зарядты ядро, ал оның айналасында электрон бұлтын түзе қозғалатын электрон бар деген теориямен толықтыру.Американ физигі Милликен электрон теріс заряд көрсете- тінін тәжірибе жүзінде дәлелдеп,оны бірге тең деп қабылдады. Атом жалпы электр- бейтарап болғандықтан, электрондар зарядының жалпы саны ядро зарядына тең.
Ал 1913 жылы Резерфордтың шәкірті Г.Мозли атом ядросындағы зарядтардың шамасы элементтің периодтық жүйедегі рет нөміріне тең болатындығын анықтады.
Мозлидің ашқан жаңалығынан кейін Менделеевтің жасаған периодтық жүйесіндегі
Ar–K,Co–Ni,Te–I элементтердің орындарының алмасуы заңды екені анықталды.Осыған байланысты,элементтердің реттік нөмірі атом ядросындағы оң зарядтың санын,сол сияқты ядро айналасында қозғалатын электрондар санын көрсетеді.
Реттік нөмірдің физикалық мәні осында. Элементтердің реттік нөмірі – оның атом ядросының заряды. Атомның ядро заряды химиялық элементтердің қасиеттерін сипаттайтын маңызды шама. Атом құрылысын одан әрі зерттеу кезінде құрамына протондар мен нейтрондар деп аталатын бөлшектер кіретіні анықталды.
Атомның элементар бөлшектері:
| Бөлшектер | Белгісі | Салыстырмалы заряды | Салыстырмалы массасы |
| Протон | р | + | 1 |
| Нейтрон | п | 0 | 1 |
| Электрон | е | − | 0 |
1. Элемент атомының массасы протон мен нейтрон массасының қосындысына тең.
2. Ядродағы протон саны элементтің реттік нөміріне тең.
А = Z + N; A – атомдық масса; Z – протон; N – нейтрон;
Табиғатта атомдық массасында айырмашылығы болатын бірдей элементтер атомы болады. Мысалы, хлор элементінің массасы 35 және 37 болатын екі түрі кездеседі. Бұл атомдардың ядросында протондар саны бірдей,ал нейтрондар саны әр түрлі. Олар изо- топтар. Изотоптар – ядро зарядтары бірдей,атомдық массалары әртүрлі атомдардың түр өзгерістері. Изотоп – бірдей орында деген мағнаны білдіреді.
Изотоптарда протон мен электрон саны бірдей, нейтрон сандары әртүрлі. Әрбір изотоп екі түрлі шамамен өлшенеді: массасы және элементтің рет нөмірі. Мысалы:
1. 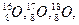 - атомдарының ядро зарядтары бірдей – оттегі изотоптары.
- атомдарының ядро зарядтары бірдей – оттегі изотоптары.
2.  - сутегінің изотоптары, аттары: протий, дейтрий, тритий.
- сутегінің изотоптары, аттары: протий, дейтрий, тритий.
Элементтердің атомдық массалары бөлшек сандармен өрнектеледі. Мысалы, хлор эле- ментінің с.а.м. 35,5. Бұл ұғымдардың айырмашылығын түсіндіру үшін мынадай мысал- дар келтіріледі. Табиғатта 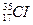 изотобы 75%, ал
изотобы 75%, ал 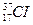 изотобы 25% таралған.Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5
изотобы 25% таралған.Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5
Периодтық жүйеде келтірілген элементтердің атомдық массалары изотоптардың табиғи қоспаларының орташа массалық саны. Изотоптар туралы мәліметтерді ескере отырып, оқушыларға химиялық элемент ұғымының нақты анықтамасын беру қажет. Химиялық элемент дегеніміз – ядро заряды бірдей атомдар түрі.Периодтық заңға атом құрылысы тұрғысынан жаңа анықтамасын береміз.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2053; Нарушение авторских прав?; Мы поможем в написании вашей работы!