
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 4. При постепенном прибавлении раствора аммиака к раствору сульфата меди образующийся вначале осадок основной меди растворяется. Составьте ионные и молекулярные
|
|
|
|
Пример 3.
Пример 2.
Пример 1.
При постепенном прибавлении раствора аммиака к раствору сульфата меди образующийся вначале осадок основной меди растворяется. Составьте ионные и молекулярные уравнения соответствующих реакций.
Решение.
Из нормальной соли CuSO4 можно получить единственную основную соль (CuOH)2SO4 (медь (II) гидроксид сульфат). Следовательно, вначале протекает следующая реакция:
2CuSO4 + 2NH4OH = (CuOH)2SO4¯ + (NH4)2SO4.
В сокращенной ионной форме уравнение имеет вид
2Cu2+ + SO42– + 2NH4OH = (CuOH)2SO4¯ + 2NH4+.
При дальнейшем добавлении аммиака осадок растворяется, так как образуется растворимое комплексное соединение. Уравнение реакции в молекулярной форме:
Cu(OH)2SO4¯ + 10NH4OH = 2[Cu(NH3)4](OH)2 + (NH4)2SO4 + 10H2O.
Ионно-молекулярное уравнение реакции:
Cu(OH)2SO4¯ + 10NH4OH = 2[Cu(NH3)4]2+ + 2OH– + 2NH4+ + SO42– + 10H2O.
К какому классу соединений относятся вещества, получаемые при действии избытка раствора аммиака на растворы AgNO3, Hg(NO3)2, Zn(NO3)2?
Составьте молекулярные и ионные уравнения реакций.
Решение.
При действии избытка раствора аммиака на растворы приведенных в условии задачи солей протекают следующие реакции:
AgNO3 + 2NH4OH = [Ag(NH3)2]NO3 + 2H2O,
Hg(NO3)2 + 4NH4OH = [Hg(NH3)4](NO3)2 + 4H2O,
Zn(NO3)2 + 4NH4OH = [Zn(NH3)4](NO3)2 + 4H2O.
Уравнения реакций в сокращенной ионной форме:
Ag+ + 2NH4OH = [Ag(NH3)2]+ + 2H2O,
Hg2+ + 4NH4OH = [Hg(NH3)4]2+ + 4H2O,
Zn2+ + 4NH4OH = [Zn(NH3)4]2+ + 4H2O.
При действии избытка аммиака образуются соединения: [Ag(NH3)2]NO3, [Hg(NH3)4](NO3)2, [Zn(NH3)4](NO3)2, которые относятся к классу комплексных соединений.
Какие степени окисления проявляет марганец в соединениях? Составьте формулы оксидов марганца, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов марганца при переходе от низшей к высшей степени окисления? Составьте уравнения реакций взаимодействия оксида марганца (II) с серной кислотой и оксида марганца (III) с гидроксидом калия.
Решение.
В соединениях марганец проявляет пять степеней окисления - (+2, +3, +4, +6, +7), но образует всего четыре простых устойчивых оксида: MnO – оксид марганца (II), Mn2O3 – оксид марганца (III), MnO2 – оксид марганца (IV) и Mn2O7 – оксид марганца (VII). Первые два оксида MnO и Mn2O3 обладают основными свойствами.
Оксид марганца (IV) амфотерен со слабо выраженными кислотными и основными свойствами. Высший оксид марганца Mn2O7 является типичным кислотным оксидом. Триоксид марганца, отвечающий степени окисления (+6), не получен.
Напишем уравнения реакций, необходимых по условию задачи:
MnO + H2SO4 = MnSO4 + H2O.
Mn2O7 + 2KOH = 2KMnO4 + H2O.
Составьте электронные и молекулярные уравнения реакций растворения золота в царской водке и взаимодействия вольфрама с хлором. Золото окисляется до степени окисления (+3), а вольфрам - до максимальной.
Решение.
Царская водка – это смесь одного объема азотной и трех – четырех объемов концентрированной соляной кислоты. При смешивании кислот образуется хлор в момент выделения, который и окисляет золото:
2HNO3 + 6HCl = 3Cl2 + 4H2O + 2NO.
Электронные уравнения:
2 | Au0 – 3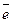 = Au+3,
= Au+3,
3 | Cl20 +2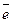 =2Cl–.
=2Cl–.
Молекулярное уравнение реакции:
2Au + 2HNO3 + 8HCl = 2H[AuCl4] + 4H2O + 2NO.
Максимальная степень окисления вольфрама, как элемента шестой группы, равна (+6). Хлор в данной задаче выступает в роли окислителя и, присоединив электроны, приобретает степень окисления (–1). На основе вышеизложенного составим электронные уравнения:
| W – 6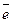 = W+6,
= W+6,
3 | Cl2 +2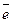 =2Cl–1.
=2Cl–1.
Уравнение реакции имеет вид
W + 3Cl2 = WCl6.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 5914; Нарушение авторских прав?; Мы поможем в написании вашей работы!