
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 6. Через подкисленный серной кислотой раствор дихромата калия пропустили газообразный сероводород
|
|
|
|
Пример 5.
Через подкисленный серной кислотой раствор дихромата калия пропустили газообразный сероводород. Через некоторое время оранжевая окраска перешла в зеленую и одновременно жидкость стала мутной. Составьте молекулярное и электронное уравнения происходящей реакции, учитывая минимальное окисление сероводорода.
Решение.
Оранжевая окраска исходного раствора обусловлена ионами Cr2O72–. Зеленый цвет после пропускания сероводорода сообщают ионы Cr3+.
Следовательно, хром (+6) восстанавливается до хрома (+3). В сероводороде степень окисления серы равна (–2). Минимальное окисление сероводорода означает, что сера (–2) отдает минимальное число электронов и приобретает степень окисления, равную нулю. Составим электронные уравнения:
2 | Cr+6 + 3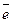 = Cr+3,
= Cr+3,
3 | S–2 – 2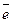 =S0.
=S0.
На основании электронных уравнений составим молекулярное уравнение реакции:
K2Cr2O7 + 4H2SO4 + 3H2S = 3S¯ + Cr2(SO4)3 + K2SO4 + 7H2O.
На гидроксиды хрома (III) и никеля (II) подействовали избытком раствора серной кислоты, едкого натрия и аммиака. Какие соединения хрома и никеля образуются в каждом из этих случаев? Составьте молекулярные и ионные уравнения реакций.
Решение.
Гидроксид хрома (III) Cr(OH)3 является амфотерным основанием. Поэтому он взаимодействует и с кислотами, и с гидроксидами:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O,
2Cr(OH)3 + 6H+ = 2Cr3+ + 6H2O.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6],
Cr(OH)3 + 3OH– = [Cr(OH)6]3–.
Cr(OH)3 + 6NH4OH = [Cr(NH3)6](OH)3 + 6H2O,
Cr(OH)3 + 6NH4OH = [Cr(NH3)6]3+ + 3OH– + 6H2O.
Гидроксид никеля (II) обладает только основными свойствами и с едким натрием не взаимодействует. В серной кислоте и аммиаке он растворяется с образованием комплексных соединений:
Ni(OH)2 + H2SO4 + 4H2O = [Ni(H2O)6]SO4,
Ni(OH)2 + 2H+ + 4H2O = [Ni(H2O)6]2+.
Ni(OH)2 + 6NH4OH = [Ni(NH3)6](OH)2 + 6H2O,
Ni(OH)2 + 6NH4OH = [Ni(NH3)6]2+ + 6H2O + 2OH–.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2377; Нарушение авторских прав?; Мы поможем в написании вашей работы!