
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры составления условий задач и их решения. Фундаментом для изучения химии является четкое представление о классах неорганических соединений и их свойствах
|
|
|
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Фундаментом для изучения химии является четкое представление о классах неорганических соединений и их свойствах. Внимательно изучив раздел о классах неорганических соединений, можно дать ответ, какие соединения называют оксидами, кислотами, основаниями, солями.
Общие свойства этих соединений приведены ниже в виде схем.

При выполнении заданий рекомендуется использовать материал практикума[1].
Для правильного составления химических уравнений необходимо использовать Прил. 1.2.
Генетическую связь между классами неорганических веществ можно изобразить следующей схемой:

Эти схемы можно использовать при написании химических уравнений и при решении задач.
Задача 41
Определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре.
Решение:
SiO2 + PbO ® PbSiO3,
оксид оксид силикат
кремния (IV) свинца (II) свинца
кислотные оксиды взаимодействуют с основными с образованием соли.
SO2 + 2NH4OH ® (NH4)2SO3 + H2O,
оксид гидроксид сульфит оксид
серы (IV) аммония аммония водорода (I)
кислотные оксиды взаимодействуют с основными гидроксидами с образованием соли и воды.
2 KСN + H2SO4 = 2 HCN + K2SO4,
цианид серная циано- сульфат
калия кислота водород калия
при взаимодействии соли с кислотой образуется новая соль и новая кислота при условии, если взятая кислота сильнее образующейся или менее летуча.
2 KHCO3 + Na2O ® Na2CO3 + K2CO3 + H2O,
гидрокарбонат оксид карбонат карбонат оксид
калия натрия (I) натрия калия водорода(I)
кислые соли могут быть переведены в средние соли при реакции с металлами, основными и амфотерными оксидами, гидроксидами, солями, кислотами.
CdOHBr + HBr ® CdBr2 + H2O,
бромид гидрок- бромо- бромид оксид
сокадмия водород кадмия водорода(I)
образование основных солей нехарактерно для сильных оснований. Подобно малорастворимым основаниям основные соли способны реагировать с кислотами с образованием средних солей.
NaOH tо ¹ не разлагается;
гидроксид
натрия
все нерастворимые в воде основания, а при сильном нагревании и гидроксиды щелочноземельных металлов разлагаются с образованием оксидов. Гидроксиды щелочных металлов при нагревании не распадаются.
Задача 54
Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na ® NaOH ® NaHCO3 ® Na2CO3 ® Na2SO4 ® NaCl ® Na.
Решение: Натрий взаимодействует с водой, образуя гидроксид натрия:
2 Na + 2 H2O = 2 NaOH + H2 .
При пропускании избытка оксида углерода (IV) через раствор гидроксида натрия можно получить гидрокарбонат натрия:
NaOH + CO2 = NaHCO3.
Карбонат натрия получается при нагревании гидрокарбоната натрия:
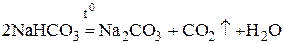 .
.
Сульфат натрия можно получить, действуя серной кислотой на карбонат натрия:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Приливая раствор хлорида бария к раствору сульфата натрия, можно получить раствор хлорида натрия:
Na2SO4 + BaCl2 = 2 NaCl + BaSO4 ¯.
Чтобы получить металлический натрий, надо выделить хлорид натрия из раствора и провести электролиз расплава NaCl. На катоде будет выделяться металл:
катод (-) Na+ + 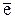 = Na.
= Na.
Задача 131
Составьте уравнения реакций. При взаимодействии каких веществ можно получить дигидрофосфат кальция?
Решение:
Са(OH)2 + 2 H3PO4 = Ca(H2PO4)2 + 2 H2O (1)
Ca3(PO4)2 + 4 H3PO4 = 3 Ca(H2PO4)2, (2)
кислые соли могут быть получены либо неполной нейтрализацией кислот (1), либо действием избытка кислот (2) на средние соли.
В задачах (1–46) определить, какие реакции будут протекать. Написать их уравнения и назвать все вещества по международной номенклатуре:
| № | Реакции | № | Реакции |
| 1. | SO3 + NH4OH ® CuO + P2O5 ® Li2SiO3 + H2SO4 ® KHCO3 + NaOH ® CdOHCl + HNO3 ® Ag + H3PO4 ® | 2. | SiO2 + RbOH ® CaO + HMnO4 ® FeCl3 + Na2SO4 ® 1K3AsO4 + 2H3AsO4 ® NiOHNO3 + HNO3 ® Ca + N2 ® |
| 3. | SiO2 + H2SO4 ® CaO + Mn2O7 ® Sr(OH)2 + (NH4)2S ® LiHSO4 + KOH ® (CuOH)2CO3 + HNO3 ® Al + HBr ® | 4. | As2O5 + RbOH ® K2O + HClO4 ® Fe(NO3)3 + Na2SO4® ZnCO3 + H2CO3 ® CuOHIO3 + H2SO4® Mg + H3PO4 ® |
| 5. | P2O5 + Ca(OH)2 ® CdO + HMnO4 ® CrCl3 + NH4OH ® BaCO3 + H2CO3 ® (CuOH)2SO4 + H2SO4 ® Hg + SnCl2 ® | 6. | SeO2 + Ba(OH)2 ® MgO + V2O5 ® FeCO3 + H3PO4 ® Ba(HS)2 + Ba(OH)2 ® (ZnOH)2SO4 + H2SO4 ® Cu + HClO4 ® |
| 7. | As2O5 + Mg(OH)2 ® Ag2O + H2SO4 ® FeS + H3PO4 ® Na2SeO3 + H2SeO3 ® Ba(OH)2 + 1 HNO3 ® Au + H2SO4 ® | 8. | SnO2 + KOH ® NH3 + H2CrO4 ® Al(NO3)3 + CuSO4 ® Ca(HCO3)2 + Ca(OH)2 ® CdOHCl + HClO4 ® Sr + N2 ® |
| 9. | CrO3 + NH4OH ® ZnO + H2SeO4 ® Sr(HSO3)2 + Sr(OH)2 ® 2CuSO4 + 2NH4OH ® NaNO3 + LiOH ® K + H2O ® | 10. | As2O3 + KOH ® Li2O + SiO2 ® CaS + CH3COOH ® Mg(H2PO4)2 + KOH ® (PbOH)2CrO4+H2CrO4 ® Ag + H2SO4 ® |
| 11. | Al2O3 + KOH ® MgO + RbOH ® Na3PO4 + BaCl2 ® ZnSO3 + H2SO3 ® FeOHCl2 + HNO3 ® Ca + N2 ® | 12. | B2O3 + KOH ® MnO + NH4OH ® K2SO3 + MgSO4 ® Ca(H2PO4)2 + KOH ® PbOHNO3 + NH4OH ® Fe + CuCl2 |
| 13. | Mn2O7 + HNO3 ® NiO + HClO4 ® Fe2(SO4)3 + RbOH ® 1K3AsO4 + 2H3AsO4 ® Mg2(OH)2CO3 + HBr ® Zn + P ® | 14. | Mn2O7 + Ca(OH)2 ® CuO + H3AsO4 ® ZnS + HClO4 ® BaHPO4 + Ba(OH)2 ® PbOHNO3 + HNO3 ® Hg + HCl ® |
| 15. | ZnO + NaOH ® NiO + H3PO4 ® K2CO3 + Ca(OH)2 ® NaHSO4 + KOH ® Mg2(OH)2CO3 + HClO4 ® Hg + CiCl2 ® | 16. | SO2 + Sr(OH)2 ® FeO + KOH ® K2CO3 + Pb(NО3)2 ® Zn(H2PO4)2 + Zn(OH)2 ® 2CuSO4 + 2NaOH ® Ca + HMnO4 ® |
| 17. | TiO2 + KOH ® HgO + HI ® Cu(NO3)2 + Sr(OH)2 ® K2SO3 + H2SO3 ® 2Pb(OH)2 + 1H2CrO4 ® Mn + BeCl2 ® | 18. | V2O5 + Mg(OH)2 ® CdO + KOH ® MnSO4 + BaCl2 ® 2Na3PO4 + 1H3PO4 ® (ZnOH)2CO3 + HNO3 ® Al + Se ® |
| 19. | MoO3 + KOH ® Fe2O3 + H3PO4 ® CuCl2 + (NH4)2S ® Cr(NO3)3 + HNO3 ® Pb(OH)2 + 1HNO3 ® Na + P ® | 20. | CrO3 + NH4OH ® FeO + SiO2 ® Ba(NO3)2 + NaOH ® Na2SO3 + H2SO3 ® (CuOH)2SO4 + HCl ® Co + HClO4 ® |
| 21. | Re2O7 + Ca(OH)2 ® CuO + HNO3 ® Al2(SO4)3 + NaOH ® LiH2PO4 + LiOH ® (CuOH)2CO3 + HCl ® Zn + CdBr2 ® | 22. | CrO3 + KOH ® HgO + H2SO4 ® Na2SO3 + KOH ® Ca3(PO4)2 + H3PO4 ® FeOHCl2 + HCl ® Ba + N2 ® |
| 23. | MoO3 + H2SO4 ® FeO + H3PO4 ® Sr(HSO4)2 + Sr(OH)2 ® Cd(OH)2 + 1HCl ® Mg + As ® AgNO3 + CuCl2 ® | 24. | CO2 + Ca(OH)2 ® MgO + P2O5 ® Na2SiO3 + H2SO4 ® Al(OH)3 + 3H2SO4 ® Bi(OH)2NO3 + HNO3 ® Zn + S ® |
| 25. | WO3 + KOH ® CaO + NaOH ® Be(NO3)2 + KOH ® Ca(HCO3)2 + K3PO4 ® CuOHCl + HBr ® Mg + Se ® | 26. | SeO2 + HClO4 ® MnO + H3AsO4 ® ZnSO3 + НNO3 ® CaCO3 + H2CO3 ® MgOHCl + H2SO4 ® Sn + HgSO4 ® |
| 27. | P2O5 + H2SO4 ® BaO + H2CrO4 ® PbS + HClO3 ® K2HPO4 + KOH ® (FeOH)2SO4 + HCl ® Cd + As ® | 28. | CaO + H2CrO4 ® V2O5 + KOH ® NaCl + H2SO4 ® BaHPO4 + K2SO4 ® (ZnOH)2CO3 + H2SO4 ® Pb + H2S ® |
| 29. | SnO + HCl ® N2O5 + LiOH ® NaOH + NH4Cl ® KHS + H2SO4 ® MgOHNO3 + HNO3 ® Al + PtCl2 ® | 30. | BaO + TiO2 ® Al2O3 + NaOH ® CuSO4 + BaS ® Pb(HSO4)2 + BaCl2 ® CuOHNO3 + HNO3 ® CuO + H2 ® |
| 31. | MgO + Al2O3 ® Cr2O3 + KOH ® Ca(OH)2 + SO2 ® FeSO4 + H2SO4 ® AlCl3 + 1 KOH ® Sn + CuSO4 ® | 32. | SnO + 2NaOH ® MnO + CO ® Cr(OH)3 + HClO4 ® Na3PO4 + AgNO3 ® 2Ca(OH)2 + H2SO4 ® Pb + AgNO3 ® |
| 33. | CuO + RbOH ® N2O3 + H2O ® KOH + ZnSO4 ® AgNO3 + MgCl2 ® KHSO4 + CuO ® Zn + Hg(NO3)2 ® | 34. | CO2 + HCl ® V2O5 + K2O ® Be(OH)2 + KOH ® (MgOH)2SO4 + H2SO4 ® Na2CO3 + CaCl2 ® Al + HCl ® |
| 35. | Na2O + Ni(OH)2 ® Re2O7 + Ca(OH)2 ® Cr(OH)3 + Ba(OH)2 ® KHCO3 + HCl ® BaCl2 + Cr2(SO)4)3 ® Fe + S ® | 36. | Al2O3 + SO3 ®
N2O5 + H2O ®
Pb(OH)2 + HNO3 ®
BaCl2 + K2CrO4®
2Co(OH)2 + 1H2SO4 ®
CaCO3 
|
| 37. | CaO + CO2 ® SeO2 + Mg(OH)2 ® CuCl2 + ZnSO4 ® Al(OH)3 + 1HCl ® KHSO4 + BaCl2 ® (NH4)2Cr2O7 ® | 38. | Li2O + HCl ® Cl2O + Mg(OH)2 ® Fe(OH)2 + O2 + H2O ® 2H3PO4 + 1Mg(OH)2 ® 2CoSO4 + 2 KOH ® Fe + CuSO4 ® |
| 39. | K2O + 2CrO3 ® P2O5 + KOH ® Be(OH)2 + HCl ® BaCl2 + Na2SO4 ® 2NiSO4 + 2KOH ® Zn + Pb(CH3COO)2 ® | 40. | Cl2O7 + Ca(OH)2 ® PbO + C ® Na2SO4 + BaCl2 ® Al(OH)3 + 3H2SO4 ® Bi(NO3)3 + 2 KOH ® Ag2CO3 ® |
| 41. | SiO2 + PbO ® SO2 + NH4OH ® KCN + H2SO4 ® KHCO3 + Na2O ® CdOHBr + HBr ® NaOH ® | 42. | Cr2O3 + H2SO4 ® K2O + NaOH ® Na2SO4 + H2SO4 ® AlOHCl2 + H2SO4 ® MnCl2 + CsOH ® KNO3 ® |
| 43. | Fe2O3 + HCl ® MgO + SO3 ® Mn(OH)2 + H2SO4 ® AlCl3 + 2 NaOH ® 2 Ca(OH)2 + H2SO4 ® Al + Fe2O3 ® | 44. | MnO + SO2 ® CO2 + KOH ® CdSO4 + H2S ® Fe(OH)2 + 2 H2SO4 ® AlCl3 + 2 NaOH ® NH4NO3 ® |
| 45. | Cr2O3 + BaO ® SiO2 + NaOH ® KMnO4 + H2SO4 ® 2 Fe(OH)3 + H2SO4 ® PbSO4 + H2SO4 ® Zn + 2 CrCl3 ® | 46. | Li2O + H2O ® Mn2O7 + CsOH ® AlCl3 + AgNO3 ® CuCrO4 + H2CrO4 ® Pb(HSO4)2 + Pb(OH)2 ® CaBr2 + Cl2 ® |
В задачах (47–96) составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
47. Cu ® CuO ® CuSO4 ® Cu(OH)2 ® Cu(OH)NO3 ® Cu(NO3)2.
48. Ca ® CaO ® CaSO4 ® Ca(OH)2 ® Ca(OH)Cl ® CaCl2.
49. S ® SO2 ® CaSO4 ® Ca(HSO4)2 ® CaSO4.
50. CuSO4 ® Cu(OH)2 ® CuO ® Cu.
51. Al ® Al2(SO4)3 ® Al(OH)3 ® AlOHCl2 ® AlCl3.
52. BaO ® BaCl2 ® Ba(OH)2 ® Ba(NO3)2 ® BaSO4.
53. Mg ® MgO ® MgCl2 ® Mg(OH)2 ® MgO.
54. Na ® NaOH ® NaHCO3 ® Na2CO3 ® Na2SO4 ® NaCl → Na.
55. Ca ® CaH2 ® Ca(OH)2 ® Ca(HCO3)2 ® CaCO3 ® CaCl2 ® Ca3(PO4)2.
56. Sn ® SnCl2 ® SnOHCl ® Sn(OH)2 ® Sn(NO3)2.
57. Na ® NaOH ® Na2SO4 ® NaNO3 ® NaNO2.
58. Al ® Al2O3 ® Al2(SO4)3 ® Al(OH)3  ® AlCl3 ® Al.
® AlCl3 ® Al.
59. Mg ® MgSO4 ® Mg(OH)2 ® MgO ® MgCl2.
60. Ba ® BaO ® BaCl2 ® Ba(NO3)2 ® BaCO3.
61. Ba ® Ba(OH)2 ® BaCO3 ® Ba(HCO3)2.
62. SeO2 ® H2SeO3 ® Mg(HSeO3)2 ® MgSeO3.
63. CuO ® Cu(NO3)2 ® Cu(OH)2 ® CuOHCl.
64. Bi2O3 ® Bi(NO3)3 ® Bi(OH)3 ® Bi(OH)2NO3.
65. K ® KOH ® KHSO4 ® K2SO4.
66. Na2SiO3 ® H2SiO3 ® NaHSiO3 ® Na2SiO3.
67. CdO ® Cd(NO3)2 ® Cd(OH)2 ® (CdOH)2SO4.
68. TeO2 ® H2TeO3 ® Ba(HTeO3)2 ® BaTeO3.
69. Sb(OH)2Cl ® SbOCl ® SbCl3 ® Sb(OH)3.
70. Cs ® CsOH ® CsHSO4 ® Cs2SO4.
71. ZnO ® Zn(NO3)2 ® Zn(OH)2 ® (ZnOH)2SO4.
72. Sn ® Sn(NO3)2 ® Sn(OH)2 ®K2[Sn(OH)4].
73. Ca ® CaSO4 ® (CaOH)2SO4 ® CaSO4.
74. Na ® NaOH ® NaHSO4 ® Na2SO4.
75. Na2SO3 ® SO2 ® H2SO3 ® S.
76. Mg ® Mg3N2 ® Mg(OH)2 ® MgO ® MgOHCl.
77. As2O3 ® As(OH)3 ® AsCl3 ® As2S3 ® Na3AsS3.
78. As ® As2O3 ® As(OH)3 ® K3AsO3 ® K3AsO4.
79. Bi ® Bi(NO3)3 ® BiONO3 ® Bi(NO3)3 ® Bi(OH)3.
80. NH3 ® NH4HCO3 ® NaHCO3 ® Na2CO3.
81. Mg2Si ® SiH4 ® SiO2 ® SiCl4 ® H2SiO3.
82. Sn ® SnCl2 ® SnCl4 ® H2SnO3 ® Na[Sn(OH)6].
83. PbS ® PbO ® PbSO4 ® Pb(HSO4)2 ® PbCl2.
84. AgO ® Ag ® AgNO3 ® Ag2O ® Ag.
85. ZnS ® ZnO ® ZnCl2 ® Zn(OH)2 ® (ZnOH)2SO4.
86. CdSO4 ® Cd ® CdO ® CdCl2 ® CdS.
87. HgSO4 ® HgCl2 ® Hg2Cl2 ® Hg2O.
88. H3BO3 ® B2O3 ® B ® H3BO3 ® Na2B4O7.
89. UO3 ® UO2Cl2 ® Na2UO4 ® Na(HUO4).
90. Fe ® FeSO4 ® Fe(OH)2 ® Fe(OH)3.
91. Fe ® Fe2(SO4)3 ® Fe(OH)3 ® FeCl3 ® Fe(OH)Cl.
92. Cr(OH)3 ® Cr2O3+…; K2Cr2O7 ® Cr2O3+…; (NH4)2Cr2O7 ® Cr2O3 +…
93. K2Cr2O7 ® Cr2(SO4)3 ® Cr(OH)3 ® Na[Cr(OH)4].
94. Al ® Al(NO3)3 ® Al(OH)3 ® Al2O3 ® NaAlO2.
95. K2MnO4 ® KMnO4 ® Mn2O7 ® HMnO4 ® NaMnO4.
96. CoCl2 ® Co(OH)2 ® Co(OH)3 ® CoCl2.
В задачах (97–137) составить уравнения реакций:
97. Из хлорида дигидроксосурьмы (III) получите хлорид гидроксосурьмы (III).
98. Из гидросульфита магния получите сульфит магния.
99. При взаимодействии каких веществ можно получить сульфат дигидроксоалюминия?
100. При взаимодействии каких веществ можно получить дигидрофосфат калия?
101. Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния?
102. Из карбонатгидроксомеди получите карбонат меди.
103. Из гидросульфата натрия при взаимодействии с металлом получите нормальные соли.
104. Из нитрата гидроксожелеза (II) получите нитрат железа (II).
105. Из гидроселената калия получите селенат калия.
106. Из гидросульфата калия при взаимодействии с оксидом получите нормальные соли.
107. Напишите формулу основных висмутовых солей азотной кислоты. Как превратить эти соли в нормальные?
108. При взаимодействии каких веществ можно получить гидроксохлорид кальция?
109. Получите карбонат гидроксомеди при действии соли слабой кислоты на среднюю соль.
110. Из сульфата свинца (II) получите гидросульфат свинца (II).
111. Из сульфата меди (II) получите сульфат гидроксомеди (II).
112. Из дигидрофосфата калия получите гидрофосфат калия.
113. Из нитрата дигидровисмута (III) получите нитрат оксовисмута.
114. При взаимодействии каких веществ можно получить гидросульфид кальция?
115. Из сульфата железа (II) получите гидросульфат железа (II).
116. При взаимодействии каких веществ можно получить сульфат гидроксоникеля?
117. При взаимодействии каких веществ можно получить гидросульфид магния?
118. На какие продукты при нагревании разлагается карбонат гидроксомеди (I)?
119. Из карбонатгидроксоцинка получите сульфат цинка
120. Из гидрокарбоната натрия действием кислоты получите хлорид натрия.
121. На какие продукты при нагревании разлагается гидрокарбонат кальция?
122. Из гидросульфида калия получите сульфид калия.
123. Из хлорида гидроксомеди получите хлорид меди.
124. На какие продукты при нагревании разлагается гидрокарбонат натрия?
125. При взаимодействии каких веществ можно получить гидроселенид кальция?
126. На какие продукты при нагревании разлагается карбонат серебра?
127. Какое взаимодействие приведет к получению сульфат гидроксоцинка?
128. Из сульфата кадмия получите гидросульфат кадмия.
129. На какие продукты при нагревании разлагается нитрат меди (II)?
130. Из бромида гидроксокадмия получите бромид кадмия.
131. При взаимодействии каких веществ можно получить дигидрофосфат кальция?
132. На какие продукты при нагревании разлагается сульфат железа (II)?
133. Какими способами можно получить гидрофосфат лития и дигидрофосфат лития?
134. Какими способами можно получить хлорид дигидроксоалюминия?
135. На какие продукты при нагревании разлагается дихромат аммония?
136. При взаимодействии каких веществ можно получить нитритдигидроксо железа (III)?
137. Из сульфата кальция получите сульфат гидроксокальция.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1359; Нарушение авторских прав?; Мы поможем в написании вашей работы!