
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория работы. Лабораторная работа №8. Определение теплоемкости твердых тел
|
|
|
|
Лабораторная работа №8. Определение теплоемкости твердых тел
Цель работы: изучить основные характеристики и виды термодинамических систем и процессов, закон сохранения энергии – первое начало термодинамики, определить молярную теплоемкость твердых тел.
Приборы и принадлежности: нагреватель, калориметр с мешалкой, термометр, два тела из различных материалов, весы.
Термодинамика – раздел физики, изучающий процессы превращения энергии при переходе термодинамической системы из одного состояния в другое.
Термодинамическая система – это тело или группа тел, условно выделенные из окружающей среды, в которой происходят термодинамические процессы.
Различают три вида термодинамических систем:
· изолированная – которая не обменивается с окружающей средой ни энергией, ни веществом;
· закрытая – которая обменивается с окружающей средой энергией, но не обменивается веществом;
· открытая - которая обменивается с окружающей средой всеми параметрами: энергией и веществом.
Термодинамический процесс – это процесс перехода системы из одного состояния с параметрами Р 1 ,V 1, Т 1 в другое с параметрами Р 2 ,V 2, Т 2, сопровождающийся превращением энергии из одного вида в другой или совершением механической работы.
Различают три вида термодинамических процессов:
· обратимые – при которых система, пройдя ряд изменений, возвращается в первоначальное состояние и при этом ликвидируются все последствия как в самой системе, так и в окружающей среде. Так как убрать последствия из окружающей среды невозможно, то необратимых процессов в природе не существует;
· необратимые - при которых не выполняются условия обратимости процесса, т.е. все процессы в природе;
· циклические – при которых сама система периодически возвращается в первоначальное состояние, но последствия в окружающей среде не ликвидируются. (По-сути, это особый вид необратимых процессов, например, циклы: день-ночь, смена пор года, физиологические циклы живых организмов и т.д.).
Любой термодинамический процесс сопровождается изменением энергии системы. Мерой изменения энергии является количество теплоты D Q ( или d Q, если мы рассматриваем бесконечно малое изменение энергии системы ).
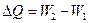 ,
,
где W 1 и W 2 – энергия начального и конечного состояния системы соответственно.
При сообщении различным телам одинаковой массы извне одинакового количества теплоты D Q температура этих тел изменится на разную величину. Например, если мы нагреваем две сковороды одинаковой массы. Пусть одна из них стальная, а вторая – чугунная. По опыту мы знаем, что быстрее будет нагреваться стальная сковорода.
Способность тела изменять свою температуру при сообщении ему количества теплоты называется теплоёмкостью. Теплоемкостью тела называется количество теплоты, которое необходимо передать телу, чтобы повысить его температуру на 1 К: 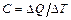 . (9.1)
. (9.1)
Размерность теплоемкости: 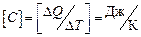 .
.
Для сравнения теплоёмкостей различных тел используют понятие удельной теплоёмкости с – теплоёмкости единицы массы вещества:
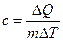 (9.2)
(9.2)
Размерность удельной теплоемкости: 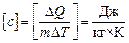 .
.
Удельная теплоёмкость численно равна количеству теплоты, необходимому для нагревания тела массой 1 кг на 1 К.
Из определения теплоемкости можно получить удобную на практике формулу для нахождения количества тепла, необходимого для изменения температуры тела на заранее заданную величину D T:
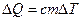 . (9.3)
. (9.3)
Молярная теплоемкость - количество теплоты, которое необходимо сообщить одному молю вещества для увеличения его температуры на 1 К:
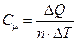 , (9.4)
, (9.4)
где n=m /μ - количество молей вещества; μ - молярная масса.
Размерность молярной теплоемкости: 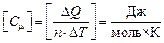 .
.
Сравнивая формулы удельной и молярной теплоемкостей, находим, что:
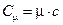 . (9.5)
. (9.5)
Определив удельную теплоемкость, можно вычислить и молярную теплоемкость.
Дюлонгом и Пти экспериментально был установлен закон, согласно которому молярные теплоемкости всех твердых тел при достаточно высоких температурах одинаковы и равны: 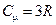 , (9.6)
, (9.6)
где R - универсальная газовая постоянная.
Каждое вещество имеет свою температуру, выше которой молярная теплоемкость не зависит от температуры и равна 3 R.
Что будет происходить с системой, например, газом при сообщении ему количества теплоты D Q?
Здесь можно условно выделить два механизма:
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1163; Нарушение авторских прав?; Мы поможем в написании вашей работы!