
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закони Фарадея
|
|
|
|
Кількісно електроліз виражають двома законами Фарадея (1833):
1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
У такому формулюванні другий закон Фарадея є наслідком закону еквівалентів (еквівалентні кількості всіх речовин, що беруть участь у реакції, однакові) для електрохімічних реакцій.
Виходячи з законів електролізу, кількість електрики, необхідна для розрядження одного моля еквівалентів будь-якої речовини відповідає одному молю елементарних електричних зарядів — постійній Фарадея.
Математично закони виражають рівнянням: v = kQ = kIτ, де v – кількість речовини (моль); k – коефіцієнт пропорційності; Q – кількість електрики (Кл); І – сила струму (А); τ – тривалість електролізу (с).
Якщо Iτ = 1 Кл, то v = k.
Електрохімічний еквівалент – це кількість речовини, що виділяється на електродах при проходженні через електроліт одного кулона електрики.
Перейдемо від кількості речовин до їх мас (через молярні маси) і врахуємо, що електрохімічний еквівалент визначається відношенням:
K=M/(zF),
де М – молярна маса речовини (г/моль); z – еквівалентне число або число електронів, що надходять від відновника до окисника; F – число Фарадея. Підставивши значення К, одержимо:
m = (MIτ)/(zF) = (EmIτ)/F
де Ет – молярна маса еквівалента (г/моль).
Отже, електрохімічний еквівалент пропорційний хімічному еквіваленту Ет = FК, а число Фарадея є добутком числа Авогадро на заряд електрона:
F = NА · e = 6,02 · 1023 · 1,60 · 10 -19 = 96485 Кл/моль.
При електролізі маси речовин, що виділяються на електродах, не залежать від температури та концентрації розчину.
13.10. Корозія металів
Процеси руйнування металів внаслідок хімічної або електрохімічної взаємодії їх з навколишнім середовищем називають корозією.
Хімічна, або газова корозія зумовлюється взаємодією металів із сухими газами або рідинами, що не проводять електричний струм, і поділяється на атмосферну та виробничу. Оксидні плівки, що при цьому утворюються, часто захищають метал від подальшої корозії або сповільнюють її дію.
Існують різні способи захисту металів від корозії, які ґрунтуються на зниженні агресивності корозійного середовища (введення інгібіторів), нанесенні захисних покрить, застосуванні електрохімічних методів (катодний і протекторний захист). Захисні покриття створюють фарбуванням, оксидуванням, металізацією та пасивуванням. За характером захисної дії металів розрізняють анодне та катодне покриття.
У випадку анодного покриття на поверхню менш активного металу наносять активніший метал, який утворює стійку проти корозії захисну плівку (наприклад, оцинковане залізо). При катодному покритті більш активний метал ізолюється малоактивним (наприклад, луджене залізо). Іржавіння оцинкованого та лудженого заліза в місцях дефектів покриття відбувається по-різному (рис. 4.7). В оцинкованому залізі руйнується цинк: він віддає електрони й переходить у гідроксид, а на поверхні заліза виділяється водень, захищаючи його від корозії. У лудженому залізі олово перестає захищати залізо, яке руйнується швидше, бо стає анодом утвореного гальванічного елемента.
Катодний захист полягає у приєднанні металу, який захищають (катода), до негативного полюса джерела постійного струму, а до позитивного полюса приєднують допоміжний матеріал (графіт, залізо), який поступово окиснюючись, захищає основний метал.
Протекторний захист здійснюється з'єднанням металу, який захищають (катода), з протектором (анодом) – більш активним металом (цинком, магнієм), який легше окиснюється.
Електрохімічна корозія – це руйнування металів у розчинах електролітів з появою у системі електричного струму. Процес виникає внаслідок утворення на поверхні металу величезної кількості гальванічних мікроелементів (гальванічних пар), в яких електродами є метал і його домішки, а електролітом – розчини кислот і солей. Потік електронів при цьому спрямований від більш активного (анода) до менш активного металу (катода). На катодах виділяється водень, аноди розчиняються.
Розчинений у воді кисень та іони Гідрогену є найважливішими окисниками, що спричинюють електрохімічну корозію.
Для прикладу розглянемо розчинення заліза з домішкою міді у розчині соляної кислоти (рис. 4.8). Більш активний метал – залізо – окиснюється, віддаючи електрони атомам міді, і переходить у розчин у вигляді іонів Fе2+. Іони ж Н+, приймаючи електрони, розряджаються на міді. Іони ОН– сполучаються з іонами Fе2+: Fе2+ + 2ОН– = Fе(ОН)2. Гідроксид Феруму (+2) за наявності кисню переходить у гідроксид Феруму (+3) 4Fе(ОН)2 + 2Н2О + О2 = 4Fе(ОН)3, який частково відщеплює воду й перетворюється на буру іржу.
Швидкість електрохімічної корозії залежить від взаємного розміщення контактуючих металів у ряді напруг, складу розчину електроліту та температури. Руйнування металів може відбуватися й під дією блукаючих струмів, які з'являються при експлуатації електротранспорту та електрокабелів у трубопроводах і підземних спорудах (електро-корозія).
Питання для самоперевірки.
1. Що таке електродні чи окисно-відновні потенціали?
2. Наведіть формулу Нернста і покажіть, як визначається потенціал електрода, зануреного в розчин з певною концентрацією катіона металу в ньому.
3. Як визначається ЕРС гальванічного елемента?
4. Який процес називається електролізом? Наведіть приклади реакцій, що відбуваються на електродах при електролізі водяних розчинів хлориду натрію і сульфату калію. Електроліз перебігає з інертним анодом.
5. Що показує число Фарадея?
6. Яка величина називається електрохімічним еквівалентом?
КОНТРОЛЬНІ ЗАВДАННЯ
1. Напишіть схему гальванічного елемента, складеного з цинкового й кадмієвого електродів, занурених у розчини їхніх солей. Обчисліть ЕРС даного гальванічного елемента при стандартних умовах.
Відповідь: 0,36 В.
2. Обчисліть, за якої концентрації йонів срібла (моль/л) потенціал срібного електрода становитиме 95% його стандартного електродного потенціалу.
Відповідь: 0,21 моль/л.
3. Обчисліть потенціал свинцевого електрода, зануреного у розчин нітрату свинцю, якщо об’єм розчину 200 см3, а маса солі в ньому 0,1 г.
Відповідь: 0,21 В.
4. Складіть схеми гальванічних елементів, електродами яких є: а) марганець і мідь; б) цинк і свинець; в) нікель і срібло, занурені в розчини відповідних солей. Який метал є анодом, а який катодом у кожному гальванічному елементі? Напишіть рівняння реакцій, що відбуваються на анодах і катодах.
Відповідь: 0,36 В.
5. Поясніть принцип роботи концентраційного гальванічного елемента. Обчисліть електрорушійну силу елемента, схема якого:
Cu½CuSO4½½ CuSO4½Cu
0,01 моль/л 0,1 моль/л
Відповідь: 0,03 В.
6. Поясніть принцип дії свинцевого акумулятора. Запишіть рівняння реакцій, що відбуваються при: а) зарядці, б) розрядці такого акумулятора. Наведіть приклади лужних акумуляторів.
7. Складіть схему гальванічного елемента зі свинцевої та магнієвої пластин, занурених у розчини їхніх солей. Напишіть рівняння електродних процесів. Обчисліть ЕРС елемента, якщо [Mg2+] = [Pb2+] = 0,01 моль/л, Т = 298 К. Чи зміниться ЕРС, якщо концентрацію кожного з іонів збільшити в однакову кількість разів?
Відповідь: 2,24 В, ні.
8. Поясніть, у чому відмінність між хімічним і електрохімічним механізмами корозії. Наведіть приклади корозії за кожним із механізмів.
9. Поясніть відмінності між видами електрохімічної корозії за характером руйнування металів. Який з цих видів корозії найбільш небезпечний для металевих конструкцій?
10. Мідну пластину покрито шаром олова. Поясніть, який метал буде піддаватися атмосферній корозії при порушенні покриття. Відповідь обґрунтуйте відповідними рівняннями реакцій.
11. Поясніть, який виріб буде більш стійким до електрохімічної корозії: а) з хімічно чистого заліза; б) з технічного заліза. Які чинники впливають на швидкість електрохімічної корозії?
12. Який виріб буде більш стійким до електрохімічної корозії при порушенні покриття: а) мідний, покритий цинком; б) цинковий, покритий міддю? Наведіть рівняння відповідних реакцій.
13. Поясніть механізм хімічної корозії металів. Які відносні значення повинна мати при цьому енергія Ґіббса?
14. Напишіть рівняння реакцій, що відбуваються на катоді при: а) кисневій деполяризації; б) водневій деполяризації.
15. Поясніть хімічні процеси, що відбуваються при електрохімічному захисті заліза від корозії.
16. Напишіть рівняння реакцій, що відбуваються на електродах з нікелю при електролізі водяного розчину нікол (ІІ) сульфату. Як зміниться маса анода за 12 хв при силі струму 2,0 А?
Відповідь: зменшиться на 0,438 г.
17. Через розчин MgCl2 пропускали струм силою 3,5 А протягом 40 хв. Яка речовина й у якій кількості виділиться на катоді?
Відповідь: 0,087 г Mg.
18. Через сполучені послідовно розчини SnCl2 і SnCl4 пропускали електричний струм силою 3,0 А протягом 10 хв. Обчисліть маси олова і хлору, що виділилися з кожного розчину.
Відповідь: 1,107 г і 0,553 г Sn, 0,662 г Cl2.
19. Визначте, за якої сили струму можна з водного розчину КОН виділити 6,2 л кисню протягом 3 годин.
Відповідь: 9,6 А.
20. Визначте, який двовалентний метал виділяється при електролізі розчину солі даного металу, якщо через розчин пропустили 1155 Кл електрики і виділили 1,2 г металу.
Відповідь: ртуть.
Приклади розв’язання задач
Приклад 1. Визначити, як зміниться потенціал залізного електрода, зануреного у розчин FеSO4, при зменшенні вмісту солі у розчині від 1 до 0,001 моль/л (умови стандартні).
Розв’язання. Електродний потенціал j (Меn+/Me) залежить від концентрації гідратованих іонів Меn+ у розчині (Меn+ × mН2О), точніше, їхньої активності. Цю залежність описують рівнянням Нернста
j (Меn+/Me) = j0 (Меn+/Me) + ,
,
де j0 (Меn+/Me) – стандартний електродний потенціал металу, В;
R – універсальна газова постійна; T – абсолютна температура, К; n – число електронів, що бере участь у реакції; F – число Фарадея, (96487 Кл).
За стандартних умов рівняння Нернста набуває вигляду:
j (Меn+/Me) = j0 (Меn+/Me) +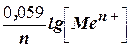 .
.
Для даної задачі j0 (Fе2+/Fе) = – 0,44 В, n = 2.
При [Fе2+] = 1 моль/л, j (Меn+/Me) = j0 (Меn+/Me) = – 0,44 В.
При [Fе2+] = 0,001 моль/л, j (Меn+/Me) = j0 (Меn+/Me) + 0,0295lg10-3 =
– 0,44 В – 0,0885 B = – 0,5285 B.
Отже, при зменшенні концентрації іонів Fе2+ у 1000 разів потенціал залізного електрода зменшиться на 0,0885 В.
Приклад 2. Скласти схему гальванічного елемента, у якому електродами є нікелева та мідна пластинки, занурені у розчини їхніх солей з активними концентраціями 1 моль/л. Зазначте, який електрод є анодом, а який – катодом. Напишіть рівняння реакцій і обчисліть електрорушійну силу (ЕРС) даного елемента.
Розв’язання. З таблиці 3 j0 (Ni2+/Ni) = – 0,25 B; j0 (Cu2+/Cu) = 0,34 B. У гальванічному елементі анодом є більш активний метал (у даному випадку це нікель), катодом менш активний (мідь). Схема цього гальванічного елемента:
(–)Ni | Ni2+ || Cu2+ | Cu(+)
Одна вертикальна риска означає межу розділу метал-розчин, а дві риски – межу розділу двох розчинів, сполучених пористою перетинкою чи трубкою з розчином електроліту.
На аноді відбувається окисний процес: Ni0 – 2е– ® Ni2+.
На катоді – відновний процес: Cu2+ + 2е– ® Cu0.
Чи сумарно: Ni0 + Cu2+ ® Ni2+ + Cu0.
Електрони рухаються від анода до катода, ЕРС гальванічного елемента можна визначити за формулою ЕРС = jкат. – jан.,
де jкат. і jан., – електродні потенціали відповідно катода й анода.
За стандартних умов ЕРС = j0кат. – j0ан., отже, у даному випадку ЕРС = 0,34 – (– 0,25) = 0,59 В.
Приклад 3. Залізний виріб покритий шаром хрому. Яке це покриття – анодне чи катодне? Скласти електронні рівняння катодного й анодного процесів корозії цього виробу при порушенні покриття у вологому повітрі.
Розв’язання. З таблиці 3 j0 (Fе2+/Fе) = – 0,44 B; j0 (Cr3+/Cr) = – 0,74 B. Оскільки j0 (Cr3+/Cr) < j0 (Fе2+/Fе), у цій системі хром є анодом, а залізо катодом. В вологому повітрі відбувається електрохімічна корозія металів. Корозійним агентом (поляризатором) є кисень. При порушенні покриття виникають мікрогальванічні пари (–)Cr | Cr3+ || Fе 2+ | Fе(+)
Анодний процес: Cr0 – 3е- ® Cr3+.
Катодний процес: О2 + 2Н2О + 4е- ® 4ОН-.
Іони хрому та групи ОН- взаємодіють: Cr3+ + 3ОН– ® Cr(ОН)3¯.
Приклад 4. Напишіть рівняння всіх реакцій, що відбуваються при електролізі водного розчину CuSO4, і визначте, яку кількість електрики (Кл) необхідно пропустити через цей розчин для виділення 96 г міді. Вихід за струмом вважайте рівним 100 %.
Розв’язання. Задана сіль утворена малоактивним металом. Оскільки j0 (Cu2+/Cu) > j0 (2H+/Н2), на катоді буде відбуватися реакція відновлення міді: Cu2+ + 2е- ® Cu0. У водних розчинах за відсутності кислотних залишків безкисневих кислот, першими окиснюються молекули води: 2Н2О – 4е– ® О2 + 4Н+.
Таким чином, при електролізі водного розчину CuSO4 на катоді виділяється мідь, на аноді – кисень, а у розчині накопичується Н2SO4.
Відповідно до першого закону Фарадея: Q = (m)/E,
де Q – кількість електрики, що пройшла крізь електроліт, Кл;
m – маса речовини, яка виділилася не електроді, г;
F – стала Фарадея, (96487 Кл); E – еквівалентна маса елемента, г/моль.
За формулою Е = А/n, де А – атомна маса елемента, n – валентність, тоді для даної задачі Q = (96 × 96487): 31,77 = 291556 Кл.
Приклад 5. Обчислити атомну масу двовалентного металу, якщо при електролізі водного розчину хлориду цього металу протягом 6 годин за сили струму 4А, на катоді виділилося 92,76 г цього металу.
Розв’язання. За першим законом електролізу Фарадея: E = (m)/(Іt),
де І – сила струму, А; t – час, с.
Для даного випадку: Е = (92,76 × 96487): (4 × 21600) = 103,6 г/моль.
Оскільки за умовою задачі n = 2, те А = Е × n = 207,2 г/моль.
З таблиці елементів Д.Менделєєва визначаємо, що цей метал – свинець.
Глава 14. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ
Для складання рівнянь окисно-відновних реакцій за допомогою іонно-електронного методу або методу напівреакцій окиснення й відновлення розглядають як самостійні процеси. Наприклад, для наведеної вище реакції визначають не ступені окиснення відповідних атомів, а заряди іонів, що беруть участь в окисненні та відновленні.
При складанні іонно-електричних рівнянь напівреакцій дотримуються певного порядку:
1) якщо вихідна речовина містить більше атомів Оксиґену, ніж продукт реакції, то у ліву частину напівреакції додають стільки іонів Гідрогену, скільки треба для зв’язування Оксиґену, а у праву частину напівреакції додають відповідне число молекул води;
2) у довідкових таблицях знаходять значення стандартних відновних потенціалів: І2 + 2e = 2I–; │ 5 φO = + 0,54 В
MnO4– + 8H+ + 5e = Mn2+ +4H2O; │ 2 φO = + 0,51 В
Напівреакцію з меншим значенням потенціалу, яка відіграє роль відновника, переписують у зворотному напрямку, а знак потенціалу змінюють на протилежний;
3) число електронів кожної напівреакції повинно дорівнювати сумарній зміні зарядів іонів. Для цього рівняння кожної напівреакції множать на такий множник, щоб зрівняти кількість втрачених і приєднаних електронів;
4) після цього рівняння обох напівреакцій підсумовують і одержують збалансоване іонне рівняння повної реакції:
2I– + 2e = І2; │ 5 φO = – 0,54 В
MnO4 – + 8H+ + 5e = Mn2+ +4H2O; │ 2 φO = + 0,51 В ______________
10І– + 2MnO4– + 16Н+ = 5І2 + 2Mn2+ + 8H2O
Позитивне значення ЕРС підтверджує можливість перебігу реакції в цілому. Розглянутий метод базується на законах збереження атомів і зарядів, а також надає можливість оцінювати глибину перетворення на основі стандартних відновних потенціалів напівреакцій.
Питання для самоперевірки
1. Які речовини можуть бути тільки окисниками, а які тільки відновниками, а які можуть виявляти як окисні так і відновні властивості в окисно-відновних реакціях?
2. Які окисно-відновні реакції називаються реакціями диспропорціонування? Наведіть приклади.
3. Які реакції називаються реакціями внутрішньомолекулярного окиснення-відновлення? Наведіть приклади.
КОНТРОЛЬНІ ЗАВДАННЯ
1. Складіть електронні і молекулярні рівняння і вкажіть, який процес – окиснення чи відновлення відбувається в наступних перетвореннях: As3+ ® ®As5+; N3+ ® N3–; S2– ® S0.
2. Виходячи зі ступеня окиснення фосфору в сполуках – К3Р, Н3РО4, Н3РО3 – визначте, яка з них є тільки окиснювачем, яка тільки відновником, а яка може виявляти як окисні, так і відновні властивості. Чому? Напишіть рівняння реакцій, що підтверджують Ваші міркування.
3. Складіть рівняння напівреакцій окиснення чи відновлення з урахуванням кислотності середовища:
а) кисле середовище: б) нейтральне середовище: в) лужне середовище:
NO3– ® NO; NO2– ® NO3–; CrO2– ® CrO42–;
MnO4– ® Mn2+ ; MnO4– ® MnO2; Al0 ® AlO2–;
2Cr3+ ® Cr2O72– ; SO32– ® SO42–; NO3– ® NH30 .
4. Чому азотиста кислота може виявляти як окисні, так і відновні властивості? Закінчити рівняння окисно-відновної реакції: КMnО4 + КNО2 + Н2SO4 ® …, склавши схему йонно-електронного балансу. Які властивості нітриту калію виявляються в цій реакції?
5. Складіть іонно-електронні рівняння і підберіть коефіцієнти методом іонно-електронного балансу для наступних окисно-відновних реакцій:
а) К2Cr2O7 + НСl + ® …; б) Аu + НNO3 + НСl ® …...
6*. а) Zn + НNO3 ® …; б) FeSO4 + КСlО3 + Н2SO4 ® ….....
7*. а) NаCrО2 + Вr2 + NаOН ® …; б) FeS + НNO3 ® ….....
8*. а) Р + НСlО3 + Н2О ® …; б) Н3AsO3 + КMnO4 + Н2SO4 ® ….....
9*. а) КСlО3 + Nа2SO3 ® …; б) КMnO4 + НВr ® ….....
10*. а) Н2S + Сl2 + Н2О ® …; б) К2Cr2O7 + Н2S + Н2SO4 ® ….....
11*. а) MnO2 + КІ + Н2SO4 ® …; б) К2Cr2O7 + FeSO4 + Н2SO4 ® ….....
12. Скільки грамів сульфіту натрію (Nа2SO3) знадобиться для відновлення в присутності сірчаної кислоти 0,05 л розчину перманґанату калію з еквівалентною молярною концентрацією 0,1 моль/л?
Відповідь: 0,315 г.
13. Чи можлива реакція між КСlО3 і MnО2 у кислому середовищі, якщо
j 0(СlО3–/Сl2) = 1,47 В, а j 0(MnО4–/MnО2) = 1,69 В?
_____________________________________________
*Дивіться умову задачі № 5.
14. У якому напрямку перебігатиме реакція: СuS + Н2O2 + НСl ® СuСl2 + S+ +Н2O, якщо jo(2H+ + S/Н2S) = 0,141 В, а jo(Н2О2/Н2О) = 1,77 В?
15. Які властивості має азотна кислота? Напишіть рівняння реакцій азотної кислоти з фосфором, магнієм, сріблом.
16. Чим пояснити окисні властивості діоксиду свинцю? Закінчите рівняння реакцій: а) РbО2 + Mn(NО3)2 + НNО3 ® НMnО4 + …; б) РbО2 + НСl(конц.) ® ….
17. Чим пояснити відновні властивості хлористого олова? Закінчіть рівняння реакцій: а) SnСl2 + ВіСl3 + КОН ® …; б) SnСl2 + НgСl2 ® ….
18. До підкисленого розчину йодиду калію (КІ) додали 0,04 л розчину нітриту калію (КNО2) з еквівалентною молярною концентрацією 0,3 моль/л. Обчисліть масу виділеногойоду й об’єм оксиду азоту (ІІ), що утворився (н.у.).
Відповідь: 1,52 м; 0,27 л.
19. Завершіть рівняння окисно-відновної реакції: Н2S + К2Cr2O7 + Н2SO4 ®, склавши схему йонно-електронного балансу. Визначте еквівалент відновника.
20. Складіть рівняння реакцій диспропорціонування:
а) Н2MnО4 ® MnО2 + НMnО4 + Н2О;
б) КВrО ® КВrО3 + КВr;
в) Сl2 + NаOН ® NаСl + NаСlО + Н2О.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2886; Нарушение авторских прав?; Мы поможем в написании вашей работы!