
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмотичний тиск
|
|
|
|
Коли у розчинах, відокремлених напівпроникною перетинкою (пропускає часточки розчинника, але не пропускає часточки розчиненої речовини), виникають нерівності концентрацій, то відбувається дифузія – процес самочинного вирівнювання концентрацій речовини внаслідок теплового руху частинок розчинника з простору з меншою концентрацією розчиненої речовини до простору з більшою концентрацією. Явище такої дифузії називається осмосом, а тиск, що є причиною осмосу – осмотичним тиском.
Осмотичний тиск розчину – це такий тиск, який створила би розчинена речовина, коли б вона перебувала у газоподібному стані при тій же температурі та займала об’єм розчину. Закон осмотичного тиску було відкрито Пфеффером та Вант-Гоффом у 1887 році. Його можна сформулювати:
осмотичний тиск розчину пропорційний молярній концентрації розчину та температурі: π = СМRT.
Даний вираз нагадує рівняння стану ідеального газу Клапейрона-Менделєєва, що свідчить про те, що у розведених розчинах частинки речовини поводяться дещо подібно до молекул газу. Виразивши молярну концентрацію через масу, молярну масу розчиненої речовини та об’єм розчину можна скласти вираз для молярної маси через осмотичний тиск.:
М = (mRT)/(πV).
Питання для самоперевірки
1. Як змінюється осмотичний тиск зі збільшенням концентрації розчиненої речовини?
2. У якому випадку пружність пари розчинника більша: над чистим розчинником чи над розчином нелеткої речовини в даному розчиннику?
3. Який фізичний зміст кріоскопічної та ебуліоскопічної констант?
4. Що таке ізотонічний коефіцієнт? Як, використовуючи закон Вант-Гофа, можна визначити його значення?
5. Як, користуючись другим законом Рауля, можна визначити масу розчиненої речовини?
КОНТРОЛЬНІ ЗАВДАННЯ
1. Розчин, що містить 80 г нафталіну (С10Н8) у 200 г діетилового етеру, кипить при 35,7 оС, а чистий етер – при 35 оС. Обчисліть ебуліоскопічну константу етеру.
Відповідь: 0,224.
2. Обчисліть кріоскопічну константу оцтової кислоти, знаючи, що розчин, що містить 4,25 г антрацену (С14Н10) у 100 г оцтової кислоти кристалізується при 15,718 оС. Температура кристалізації оцтової кислоти 16,65 оС.
Відповідь: 3,9.
3. Обчисліть температуру кипіння розчину нафталіну (С10Н8) у бензолі з масовою часткою нафталіну 5 %. Температура кипіння бензолу 80,2 оС, а ебуліоскопічна константа його дорівнює 2,57.
Відповідь: 81,25 оС.
4. При розчиненні 4,86 г сірки в 60 г бензолу температура кипіння його підвищилася на 0,81 оС. Скільки атомів сульфуру містить молекула сірки в цьому розчині, якщо ебуліоскопічна константа бензолу дорівнює 2,57?
Відповідь: 8.
5. Температура кристалізації розчину, що містить 66,3 г деякого неелектроліту в 500 г води дорівнює – 0,558 оС. Обчисліть молекулярну масу розчиненої речовини. Кріоскопічна константа води дорівнює 1,86.
Відповідь: 442 г/моль.
6. Обчисліть температуру кристалізації розчину етилового спирту з масовою часткою С2Н5ОН 2%, якщо кріоскопічна константа води дорівнює 1,86.
Відповідь: – 0,82 оС.
7. Скільки грамів сечовини ((NH2)2CO) слід розчинити в 250 г води, щоб температура кипіння підвищилася на 0,26 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 7,5 г.
8. При розчиненні 2,3 г деякого неелектроліту в 125 г води температура кристалізації понизилася на 0,372 оС. Обчисліть молярну масу розчиненої речовини. Кріоскопічна константа води Ккр. = 1,86.
Відповідь: 92 г/моль.
9. Обчисліть температуру кипіння водного розчину з масовою часткою гліцерину (С3Н5(ОН)3) 15 %. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 100,997 оС.
10. Обчисліть масову частку глюкози (С6Н12О6) у водному розчині, знаючи, що цей розчин кипить при 100,26 оС. Ебуліоскопічна константа води рівна 0,52.
Відповідь: 8,26 %.
11. Скільки грамів фенолу (С6H5ОН) слід розчинити в 125 г бензолу, щоб температура кристалізації розчину була нижче температури кристалізації бензолу на 1,7 оС. Кріоскопічна константа бензолу дорівнює 5,1.
Відповідь: 3,91 г.
12. Обчисліть масову частку метанолу (СН3ОН) у водному розчині, температура кристалізації якого to = – 2,79 оС. Кріоскопічна константа води Kкр. = 1,86.
Відповідь: 4,58 %.
13. Обчисліть молярну масу неелектроліту, знаючи, що розчин, що містить 2,25 г цієї речовини в 250 г води кристалізується при температурі – 0,279 оС. Кріоскопічна константа води дорівнює 1,86.
Відповідь: 60 г/моль.
14. Обчисліть масову частку гліцерину (С3Н5(ОН)3) у водному розчині, знаючи, що цей розчин кипить при 100,39 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 6,45 %.
15. Розчин, що містить 3,04 г камфори (С10H16O) у 100 г бензолу, кипить при 80,714 оС. Температура кипіння бензолу 80,2 оС. Обчисліть ебуліоскопічну константу бензолу.
Відповідь: 2,57.
16. Обчисліть температуру кристалізації розчину сечовини, що містить 5 г сечовини ((NH2)2CO) у 150 г води. Кріоскопічна константа води дорівнює 1,86.
Відповідь: – 1,03 оС.
17. Скільки грамів карбаміду ((NH2)2CO) слід розчинити в 125 г води, щоб температура кипіння підвищилася на 0,26 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 3,75 г.
18. Чόму дорівнює осмотичний тиск розчину глюкози (С6Н12О6) з молярною концентрацією 0,5 моль/л при 25 оС?
Відповідь: 1,24 МПа.
19. Обчисліть осмотичний тиск розчину, що містить 16 г С12Н22О11 (цукрози) у 150 г води. Густину розчину вважати рівною 1.
Відповідь: 311 кПа.
20. При 25оС осмотичний тиск розчину, що містить 2,8 г високомолекулярної сполуки в 200 мл розчину, дорівнює 0,7 кПа. Знайдіть Mr розч. речовини.
Відповідь: 4,95 × 104 а.о.м.
21. Скільки молів неелектроліту повинен містити 1 л розчину, щоб його осмотичний тиск при 25 оС дорівнював 2,47 кПа?
Відповідь: 0,001 моль.
22. Чόму дорівнює осмотичний тиск розчину аніліну (С6Н5NH2), у 1 л якого міститься 3,1 г цієї речовини при температурі 21 оС?
Відповідь: 8 × 104 Па.
23. Визначте осмотичний тиск розчину, що містить у 1 л 18,4 г гліцерину (С3Н5(ОН)3) при температурі 0 оС.
Відповідь: 4,54 × 102 Па.
24. Визначте осмотичний тиск розчину, що містить 190 г глюкози (С6Н12О6) у 4 л розчину при температурі 27 оС.
Відповідь: 3,12 × 102 Па.
25. У 0,5 л розчину міститься 2 г неелектроліту. Цей розчин при температурі 0 оС має осмотичний тиск, рівний 5,1 × 104 Па. Визначте молекулярну масу розчиненої речовини.
Відповідь: 178 а.o.м.
26. Знайдіть при 65 оС тиск пари над розчином, що містить 13,68 г цукрози (С12Н22О11) у 90 г води, якщо тиск насиченої пари над водою при тій самій температурі дорівнює 25 кПа (187,5 мм рт.ст).
Відповідь: 24,8 кПа.
27. Чому дорівнює тиск насиченої водяної пари над 10 % розчином карбаміду ((NH2)2CO) при 100 оС, якщо над водою він дорівнює 101320 Па?
Відповідь: 98 кПа.
28. Визначте тиск пари над розчином сечовини у воді з масовою часткою ((NH2)2CO) 10 % при 100 оС, якщо р0(Н2О) = 115 844 Па?
Відповідь: 1,12 × 105 Па.
29. Визначте відносну молекулярну масу аніліну, знаючи, що при температурі 30 оС тиск пари над розчином аніліну, що містить 3,09 г цієї речовини в 370 г етеру дорівнює 8,58 × 104 Па. Тиск пари чистого етеру при цій же температурі дорівнює 8,64 × 104 Па.
Відповідь: 92 а.о.м.
30. При 65 оС тиск пари над водою дорівнює 25003 Па. Визначте тиск пари над розчином 34,2 г цукру (С12Н22О11) у 90 г води за цієї ж температури.
Відповідь: 24512 Па.
31. Тиск водяної пари над розчином неелектроліту при температурі 80 оС дорівнює 1,4 × 104 Па. Скільки молів води приходиться на 1 моль розчиненої речовини, якщо тиск пари води при цій же температурі дорівнює 47375 Па.
Відповідь: 2,4.
32. Тиск пари над водою при 50 оС дорівнює 12334 Па. Обчисліть тиск пари над розчином 50 г етиленгліколю (С2Н4(ОН)2) у 900 г води при цій же температурі.
Відповідь: 12140 П а.
Приклади розв’язання задач
Приклад 1. Обчислити температури кристалізації і кипіння водного розчину глюкози з масовою часткою C6Н12O6 2%.
Розв’язання. За законом Рауля зниження температури кристалізації і підвищення температури кипіння розчину (Dto) у порівнянні з температурами кристалізації і кипіння розчинника виражається рівнянням
 (8.1.)
(8.1.)
де К – кріоскопічна чи ебуліоскопічна константа (для води вони відповідно рівні 1,86 і 0,52 град/(кг × моль)); m і М – відповідно маса і молярна маса розчиненої речовини; m1 – маса розчинника (г).
Зниження температури кристалізації 2-відсоткового розчину C6Н12O6 знаходимо за формулою (8.1): 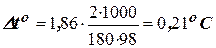 .
.
Вода кристалізується при 0оC, отже температура кристалізації розчину складе toкрист. = 0 – 0,21 = – 0,21оC.
За формулою (8.1) знаходимо підвищення температури кипіння 2%-го розчину  .
.
Вода кипить при 100оC, отже температура кипіння цього розчину буде toкип. = 100 + 0,06 = 100,06оC.
Приклад 2. Розчин, що містить 1,22 г бензойної кислоти C6Н5СООН у 100 г сірковуглецю, кипить при 46,529оC. Температура кипіння сірковуглецю 46,3оС. Обчислити ебуліоскопічну константу сірковуглецю.
Розв’язання. Підвищення температури кипіння Dto = 46,529 – 46,3 = =0,229оC. Молярна маса бензойної кислоти складає 122 г/моль. За формулою (8.1) знаходимо ебуліоскопічну константу:
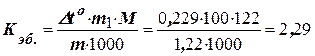 град/(кг × моль).
град/(кг × моль).
Приклад 3. Розчин, що містить 11,04 г гліцерину в 800 г води кристалізується при – 0,279оC. Обчислити молярну масу гліцерину.
Розв’язання. Температура кристалізації чистої води дорівнює 0оC, а зниження температури кристалізації Dto = 0 – (– 0,279o) = 0,279оC. Маса гліцерину, що доводиться на 1000 г води, дорівнює (11,04 × 1000): 800 = 13,8 г. Підставляючи в рівняння (8.1), знаходимо М:
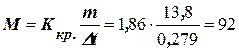 г/моль.
г/моль.
Приклад 4. Обчислити масову частку сечовини ((NH2)2CO) у водному розчині, знаючи, що температура кристалізації цього розчину to = – 0,465оC.
Розв’язання. Температура кристалізації чистої води дорівнює 0оC, отже зниження температури кристалізації Dto = 0о – (– 0, 465o) = 0,465оC. Молярна маса сечовини становить 60 г/моль. Знаходимо масу розчиненої речовини, що припадає на 1000 г води за формулою:
 г.
г.
Загальна маса розчину, що містить 15 г сечовини, дорівнює 1000 + 15 = =1015 г. Масову частку сечовини знаходимо за формулою:
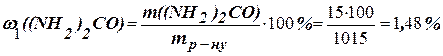
Приклад 5. Обчислити осмотичний тиск розчину, що містить у 1,4 л 63 г глюкози (C6Н12O6) при 0оC.
Розв’язання. Осмотичний тиск розчину визначають за законом Вант-Гоффа 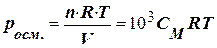 (8.2.)
(8.2.)
де n – кількість розчиненої речовини; V – об’єм розчину, м3; R – універсальна газова стала (8,314 Дж/(моль × К)); T – абсолютна температура, K; СМ – молярна концентрація, моль/л.
У 1,4 л розчини міститься 63 г глюкози, молярна маса якої дорівнює 180,16 г/моль. Отже, кількість глюкози, що міститься в 1,4 л:
n = 63: 180,16 = 0,35 моль.
Осмотичний тиск цього розчину глюкози становитиме
 Па.
Па.
Приклад 6. Обчислити тиск пари над розчином, що містить 34,23 г цукру (C12Н22O11) у 45,05 г води при 65оC, якщо тиск пари води при цій температурі дорівнює 2,5 × 104 Па
Розв’язання. Тиск пари над розчином неелектроліту та нелеткої речовини у певному розчиннику завжди нижчий тиску пари над цим же чистим розчинником за однакової температури. Відносне зниження тиску пари розчинника над розчином відповідно до закону Рауля виражають співвідношенням
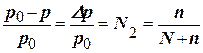 (8.3.)
(8.3.)
де р0 і р – тиски пари відповідно над чистим розчинником і розчинника над розчином; N2 – мольна частка розчиненої речовини; n – кількість молів розчиненої речовини; N – кількість молів розчинника.
Молярна маса цукру (C12Н22O11) дорівнює 342,3 г/моль, молярна маса води – 18,02 г/моль. Таким чином, кількість розчиненої речовини n = 34,23:342,3= = 0,1 моль, а води N = 45,05:18,02 = 2,5 моль.
Отже, тиск пари над розчином становитиме
 Па.
Па.
Глава 11. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ.
На підставі вивчення електропровідності розчинів шведський вчений Сванте Арреніус у 1887 році розробив основні положення теорії електролітичної дисоціації. Електролітами називаються речовини, розчини чи розплави яких проводять електричний струм. До електролітів відносяться речовини, у формульних одиницях яких атоми пов’язані йонним або ковалентним полярним зв’язком, здатним розпадатися гетеролітично (тобто без розриву зв’язуючих електронних пар). До електролітів (у водних розчинах) відносяться солі, розчинні кислоти, луґи. Речовини, розчини чи розплави яких не проводять електричного струму називаються неелектролітами (напр. віск, цукор, сірка, тощо).
Електролітична дисоціація (у рідких розчинах) – це процес розпаду електроліту на сольватовані йони під дією молекул розчинника.
11.1. Основні положення теорії електролітичної дисоціації
Сучасний зміст цієї теорії можна звести до трьох наступних положень:
1. Електроліти при розчиненні у воді розпадаються (дисоціюють) на йони – позитивно та негативно заряджені частинки. Властивості йонів відрізняються від властивостей нейтральних атомів. Наприклад металевий натрій (атоми натрію) енергійно взаємодіє з водою з виділенням водню, у той час як іони натрію (у відповідних солях) водню з води не виділяють. Атоми хлору утворюють двоатомні молекули, які отруйні та мають різкий запах. Іони хлору є відносно неотруйними та не мають запаху.
2. Під дією електричного струму йони набувають спрямованого руху: додатно заряджені йони рухаються до катоду, а від’ємно заряджені – до аноду. Тому перші називаються катіонами, а другі – аніонами.
3. Дисоціація – процес оборотній. Це означає, що паралельно з розпадом молекул і кристалів на йони (дисоціацією) перебігає процес сполучення йонів у молекули (асоціація, рекомбінація).
11.2. Ступінь дисоціації
Кількісно процес дисоціації характеризується ступенем дисоціації a. Це є відношення числа дисоційованих молекул до загального числа розчинених молекул: a = n/N, де n – кількість молекул, які розпалися на йони, тобто дисоційованих; N – загальне число розчинених молекул.
Ступінь дисоціації виражається у частках одиниці або у відсотках. Якщо a = 1, то всі молекули розпались на йони. Ступінь дисоціації HCI дорівнює 91% чи 0,91. Це означає, що зі 100 молекул HCI розпалось на йони 91 молекула, а 9 молекул не розпалось.
Ступінь дисоціації залежить від наступних чинників:
1) хімічної природи електроліту та розчинника;
2) концентрації електроліту;
3) температури.
1 чинник. Різні електроліти мають різну схильність до розщеплення на йони. Наприклад, для розчинів H2SO4 и H2CO3 однакової молярної концентрації (0,01 моль/л) ступені дисоціації відповідно дорівнюють 58 % та 0,17 %. Деякі електроліти добре дисоціюють у воді, інші у рідкому аміаку.
2 чинник. По мірі розведення розчину, тобто зі зменшенням концентрації електроліту ступінь дисоціації збільшується, оскільки йони все більш віддаляються один від іншого та зменшується можливість їхнього зворотного сполучення у молекули.
3 чинник. З підвищенням температури ступінь дисоціації збільшується. Більшість електролітів розпадається на йони з поглинанням тепла, тобто дисоціація – це ендотермічний процес і згідно з принципом Ле-Шательє при нагріванні рівновага зсувається в бік дисоціації.
У залежності від величини ступеню дисоціації всі електроліти поділяються на: 1) сильні електроліти, a > 30%. До них відносяться:
а) практично всі солі;
б) мінеральні кислоти, наприклад HCI, HBr, HI, HSCN, HNO3, H2SO4, HMnO4, H2SeO4, HCIO4;
в) гідроксиди лужних і лужноземельних металів: LiOH, NaOH, KOH, Ва(OH)2, тощо.
2) слабкі електроліти, a < 3%. До них відносяться:
а) практично всі орґанічні кислоти, деякі мінеральні кислоти, наприклад: H2CO3, H2S, HNO2, HCIO, H2SiO3, HCN, H3BO3.
б) H2O, NH4OH і важко розчинні гідроксиди металів.
Вирізняють також електроліти середньої сили. Їх ступінь дисоціації знаходиться в інтервалі 3 – 30%. До них відносяться: H3PO4, H2SO3, Mg(OH)2, однак частіше їх все ж відносять до слабких електролітів.
11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
У розчині слабкого електроліту встановлюється рівновага між молекулами та йонами, тому для них справедливі загальні закони рівноваги. Наприклад, для процесу дисоціації оцтової кислоти можна записати вираз для константи рівноваги: СН3СООН ↔ СН3СОО- + Н+;
Крівн =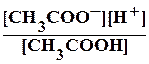 .
.
Константа рівноваги, що відповідає дисоціації слабкого електроліту називається константою дисоціації.
У загальному вигляді: КА ↔ К+ + А-. Застосовуючи закон дїї мас, можна записати: Крівн =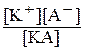 (7.2.)
(7.2.)
Якщо ступінь дисоціації – a, а концентрація електроліту – С, то
[К+] = [А‑] = aС, де aС – концентрація йонів; тоді [КА] = (С – aС) – концентрація недисоційованих молекул. Підставляючи вирази для [КА], [К+], [А-] у рівняння (7.2.), одержимо: Крівн = .
.
Якщо a є дуже малим, тобто a «1, тоді:
К = a2С або a = (7.3)
(7.3)
Це рівняння виражає закон розведення Оствальда. Воно показує, що при розведенні ступінь дисоціації зростає. Константа дисоціації є величиною, властивою даному електролітові. При сталій температурі в одному й тому ж розчиннику вона є величиною сталою. Ступінь дисоціації характеризує склад електроліту в розчині тільки даної концентрації та змінює ся з її зміною. Константа дисоціації залежить від хімічної природи електроліту та розчиннику, температури, але не залежить від концентрації. Вона характеризує здатність електроліту розпадатися на йони. Чим більше константа дисоціації, тем легше електроліт розпадається на йони.
Багатоосновні кислоти та багатокислотні основи дисоціюють постадійно. Кожна стадія дисоціації характеризується своєю константою дисоціації.
Наприклад: Н2СО3 ↔ Н+ + НСО3-; перша стадія К1 = 4,5 · 10-7
НСО3- ↔ Н+ + СО32-; друга стадія К2 = 4,7 · 10-11
З нерівності К1 > К2 видно, що дисоціація переважно йде за першою стадією. Орієнтовно можна вважати, що кожна наступна константа дисоціації менше попередньої приблизно у 105 разів.
11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
Як зазначалося вище, на стан рівноваги електролітичної дисоціації слабкого електроліту впливає концентрація розчину. Зсунути рівновагу можна також зміною концентрації одного з іонів, що знаходяться у розчині. Так, введення у розчин СН3СООН ↔ СН3СОО‑ + Н+ ацетату натрію (СН3СООNa) збільшує концентрацію СН3СОО‑, що призведе до зсуву рівноваги дисоціації вліво й пониженню кислотності середовища. Таким чином, введення у розчин слабкого електроліту однойменних іонів зменшує його ступінь дисоціації.
11.5. Розчини сильних електролітів
Сильні електроліти у водних розчинах повністю розпадаються на йони. В наслідок великого числа йонів у розчині йони взаємодіють один з одним завдяки наявності значних електростатичних сил, що діють між ними. Це призводить до удаваного зменшення ступеню дисоціації, до зменшення електропровідності розчинів сильних електролітів. Тому рівняння закону дії мас незастосовне для сильних електролітів. У 1907 році американський вчений Льюїс вводить поняття про удавану концентрацію – активність.
Активність іона – це та ефективна умовна концентрація його, відповідно до якої він діє у хімічних реакціях (а). Активність іону пов’язана з концентрацією рівнянням: а = γС,
де γ – коефіцієнт активності, він враховує взаємодію даного йона із навколишнім середовищем, залежить від концентрації та зарядів іонів. У концентрованих розчинах γ < 1. Для гранично розведених розчинів, де відсутні сили взаємодії йонів із-за їхньої віддаленості один від іншого, γ = 1, а а = С.
11.6. Електролітична дисоціація води. Йонний добуток води.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 7666; Нарушение авторских прав?; Мы поможем в написании вашей работы!