
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тиск пари розчинника над розчином
|
|
|
|
Якщо розчинити у рідині нелетку речовину, то тиск насиченої пари розчинника над рідиною знижується, бо зменшення концентрації розчинника порушує рівновагу рідина – пара. Залежність зниження тиску пари розчинника над розчином залежно від його концентрації виражається першим законом Рауля (1887): відносне пониження тиску насиченої пари розчинника над розчином дорівнює мольній (молярній) частці розчиненої речовини:
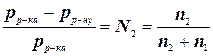 |
де рр-ка та рр-ну – тиск насиченої пари розчинника над чистим розчинником і над розчином, а n1 та n2 – кількості розчинника та розчиненої речовини відповідно.
Закон Рауля виведено для розчинів нелетких речовин у летких розчинниках. Якщо ж парціальним тиском розчиненої речовини не можна знехтувати, то закон Рауля залишається справедливим для розчинника, а для розчиненої речовини є справедливим закон Генрі, згідно з яким розчинність леткої речовини пропорційна її парціальному тискові:
Рреч. = k · N2.
10.2. Температури замерзання та кипіння розчинів
Зниження тиску пари над розчином впливає на температуру замерзання (кристалізації) та кипіння розчинів. Явища пониження температури замерзання розчинів і підвищення температури кипіння розчинів нелетких речовин одержали назви кріоскопії та ебуліоскопії відповідно. Згідно з другим законом Рауля (наслідок із першого закону): підвищення температури кипіння та зниження температури замерзання розчину відносно чистого розчинника пропорційні моляльній концентрації розчиненої речовини:
ΔТкип. = Кебул. · μ; ΔТзам. = Ккріоск. · μ,
де μ – моляльна концентрація розчиненої речовини, а Кебул. та Ккріоск – ебуліоскопічна та кріоскопічна константи, які залежать лише від властивостей розчинника – його температури кипіння (замерзання), молярної маси та теплоти випаровування (плавлення): К = (RT2M): ΔН.
За зміною температур кипіння та замерзання розчинів можна визначити молярну (молекулярну) масу розчиненої речовини.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 588; Нарушение авторских прав?; Мы поможем в написании вашей работы!