
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон гей-люссака
|
|
|
|
При сталому тискові об’єм газу змінюється пропорційно абсолютній температурі (Т): V1/T1 = V2/T2 або V/T = const.
1.3.5. ОБ’ЄДНАНИЙ ЗАКОН БОЙЛЯ – МАРІОТТА ТА ГЕЙ-ЛЮСАКА
Рівняння стану газу можна подати у вигляді співвідношення: 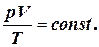
зручного для порівняння параметрів певного газу в двох його різних станах.
Цей закон часто використовують для приведення об’єму до нормальних умов: 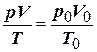 ,
,
де p0, V0, T0 – відповідно тиск, об’єм і температура за нормальних умов (р0 = 101325 Па, T0 = 273К).
1.3.6. РІВНЯННЯ МЕНДЕЛЄЄВА – КЛАПЕЙРОНА
Загальним рівнянням стану ідеального газу є рівняння є рівняння Менделєєва – Клапейрона: рV = nRT або 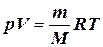 ,
,
де n - число молів газу; m – маса газу, кг; р – тиск газу, Па; М – молярна маса газу, кг/моль; V – об’єм газу, м3; Т – температура, К; R – універсальна газова стала (R = =8,314 Дж/(моль×К)).
1.4. ПРАВИЛО ДЮЛОНҐА ТА ПТІ
Для визначення атомних мас елементів, що не утворюють летких простих речовин, запропоновано метод, який базується на правилі Дюлонґа та Пті (1819): атомна теплоємність більшості простих речовин у твердому стані приблизно однакова для всіх елементів і дорівнює ~26 Дж/(моль × К). Атомна теплоємність (кількість теплоти, потрібна для нагрівання 1 моля атомів елемента на 1 К) є добутком питомої теплоємності (кількості теплоти, необхідної для нагрівання 1 кг речовини на 1 К) на молярну масу атомів елемента.
С = сА, де С і с – атомна та питома теплоємності; А – атомна маса.
Поділивши число 26 на визначену експериментально питому теплоємність речовини, можна знайти наближено значення молярної маси атомів відповідного елемента: А=26/с
Питання для самоперевірки
1. Які основні положення атомно-молекулярного вчення?
2. Що означають поняття: елемент, атом, молекула, формульна одиниця, речовина?
3. Що називається відносною густиною газу? Яка залежність між молекулярною масою газу та його густиною щодо водню, повітря?
4. Як оцінюються абсолютні маси атомів і молекул? Чόму дорівнюють маси молекул води, фтору?
5. Що показує число Авогадро?
6. Що таке еквівалент елемента? Чи є еквівалент елемента сталою величиною?
7. Обчисліть еквівалентні маси манґану в наступних сполуках: MnSO4, MnО2, K2MnО4, KMnО4.
8. У чому сутність закону еквівалентів?
КОНТРОЛЬНІ ЗАВДАННЯ
1. Визначте еквівалентні маси металу та сульфуру, якщо 3,24 г металу утворюють 3,48 г оксиду та 3,72 г сульфіду.
Відповідь: 108 г/моль; 16 г/моль.
2. Арсен утворює два оксиди. Масова частка арсену в одному з них 65,2%, а в іншому – 75,7%. Визначте еквівалентні маси арсену в обох випадках.
Відповідь: 15 г/моль; 25 г/моль.
3. Оксид металу містить 28,57% окиґену, а флуорид того ж металу 48,72% флуору. Знайдіть еквівалентну масу флуору.
Відповідь: 19 г/моль.
4. 2,14 × 10-3 кг металу витісняють з кислоти 2 × 10-3 м3 водню (н.у.). Обчисліть еквівалентну масу металу.
Відповідь: 11,98 г/моль.
5. Чому дорівнює за нормальних умов еквівалентний об’єм кисню? На спалювання 1,5 г двовалентного металу потрібно 0,69 л кисню (н.у.). Обчисліть еквівалентну, молярну й атомну маси металу.
Відповідь: 12,17 г/моль; 24,35 г/моль; 24,35 а.о.м.
6. Та сама кількість металу сполучається з 0,6 × 10-3 кг кисню і з 9,534 × 10-3 кг галогену. Обчисліть еквівалентну масу галогену.
Відповідь: 127,1 г/моль.
7. Обчисліть еквівалентну масу H3PO4 у реакціях утворення:
а) гідроортофосфату; б) ортофосфату.
8. Знайдіть еквівалентну масу H2SO4 і Cu(OH)2 у наступних реакціях:
а) H2SO4 + 2KOH = K2SO4 + 2H2O;
б) H2SO4 + KOH = KHSO4 + H2O;
в) Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
г) Cu(OH)2 + HCl = CuOHCl + H2O;
9. На нейтралізацію 1,125 × 10-3 кг щавлевої кислоти знадобилося 10-3 кг NaOH. Визначте еквівалентну масу кислоти.
Відповідь: 45 г/моль.
10. У якій кількості Cr(OH)3 міститься стільки ж еквівалентів, скільки в 174,96 г Mg(OH)2
Відповідь: 205,9 г.
11. Визначте масу металу, що витиснув з кислоти 7 × 10-3 м3 водню (н.у.), якщо еквівалентна маса металу 28 г/моль.
Відповідь: 1,75 × 10-3 кг.
12. На нейтралізацію 9,797 г ортофосфорної кислоти витрачено 7,998 г NaOH. Визначте кількість еквівалентів, еквівалентну масу й основність H3PO4 у цій реакції. На підставі розрахунку напишіть рівняння реакції.
Відповідь: 0,5; 49 г/моль; 2.
13. Скільки молекул міститься в 1 мл водню за нормальних умов?
Відповідь: 2,69 × 1019.
14. Який об’єм (н.у.) займають 2,7 × 1022 молекул газу?
Відповідь: 1 л.
15. Маса 400 мл ацетилену (н.у.) дорівнює 0,464 г. Визначте молекулярну масу ацетилену.
Відповідь: 26 г/моль.
16. Визначте масу молекули газу в кг, якщо маса 10-3 м3 газу за нормальних умов дорівнює 1,785 × 10-4 кг.
Відповідь: 6,65 × 10-27 кг.
17. Маса 0,002 м3 газу за нормальних умов дорівнює 0,0042 кг. Визначте молярну масу газу та його густину за повітрям.
Відповідь: 47 г/моль, 1,62.
18. За певної температури густина пари сірки за азотом дорівнює 9,14. Зі скількох атомів складається молекула сірки за цієї температури?
Відповідь: з 8 атомів.
19. Обчисліть об’єм 3 кг азоту при тиску 1,05 × 105 Па і tо = 50оС.
Відповідь: 2,8 м3.
20.За нормальних умов маса 5 × 10-4 м3 газу дорівнює 1,806 × 10-3 кг. Визначте густину газу за повітрям і етаном (С2Н6) і відносну молекулярну масу газу.
Відповідь: 2,8; 2,7; 81а.о.м.
21. Обчисліть відносну молекулярну масу речовини, якщо маса 7 · 10-4 м3 її пари при 91оС та тиску 9,7 × 104 Па дорівнює 2,68 × 10-3 кг.
Відповідь: 119,4 а.о.м.
22. Газ, густина якого за повітрям дорівнює 0,55, міститься у посудині місткістю 0,02 м3 під тиском 1,038 × 105 Па при температурі 20оС. Визначте масу газу в цій посудині.
Відповідь: 13,6 г.
23. За якого тиску маса 8 × 10-3 м3 хлору буде становити 2,5 × 10-3 кг, якщо температура дорівнює 23оС?
Відповідь: 10832 Па.
24. Скільки молекул SO2 утвориться при згорянні 2 × 10-6 кг сірки?
Відповідь: 3,762 × 1019.
25. У якій масі карбон (IV) хлориду міститься стільки ж молекул, скільки їх у 5 × 10-3 м3 води?
Відповідь: 42,7 г.
26. Знайдіть точну атомну масу елемента, якщо з 1,5 × 10-3 кг цього елемента одержується 3,63 × 10-3 кг хлориду. Питома теплоємність цього елемента 0,347 кДж/(кг×К).
Відповідь: 75 а.о.м.
27. Метал, питома теплоємність якого дорівнює 0,241 кДж/(кг·К), утворює оксид, що містить 6,9 % оксиґену. Знайдіть ступінь окиснення металу.
Відповідь: +1.
28. На окиснення 3,06 × 10-3 кг металу витрачається 5,6 × 10-4 м3 кисню (н.у.). Питома теплоємність металу 0,138 кДж/(кг×К). Обчисліть точну атомну масу металу.
Відповідь: 183,6 а.о.м.
29. Визначте молекулярну формулу речовини, що містить 93,75 % карбону і 6,25% гідроґену, якщо густина пари цієї речовини за повітрям дорівнює 4,41.
Відповідь: С10Н8.
30. Визначте найпростішу формулу речовини, що містить 43,4 % натрію, 11,3 % карбону і 45,3 % оксиґену.
Відповідь: Na2CO3.
Приклади розв’язання задач
Приклад 1. Який об’єм за нормальних умов займають: а) 5,5 г СО2; б) 0,025 моль H2S; в) 6,02 · 1021 молекул NH3?
Розв’язання. а) Із закону Авогадро випливає, що за однакових умов 1 моль будь-якого газу займає той самий об’єм. Цей об’єм називається молярним об’ємом газу і за нормальних умов дорівнює 22,4 л. Молярна маса СО2 дорівнює 44 г/моль. Отже, для кількості речовини (ν) справедливо
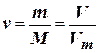 , звідки
, звідки 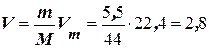 л.
л.
б) Із закону Авогадро випливає, що об’єм 0,025 моль H2S за нормальних умов
V = Vm · ν = 22,4 · 0,025 = 0,56 л.
в) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
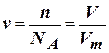 , звідки
, звідки 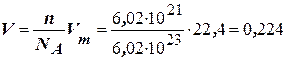 л.
л.
Приклад 2. Густина газу за повітрям дорівнює 1,17. Визначити молекулярну масу і його густину за воднем.
Розв’язання. Із закону Авогадро випливає, що відносна густина (D) одного газу за іншим дорівнює відношенню молярних мас цих газів, тобто D = =М1/М2, отже D пов.(газу) = Мгазу/Мпов . = 1,17. Середня молярна маса повітря дорівнює 29,0 г/моль. Тоді Мгазу = 1,17 × 29,0 = 33,9 г/моль, що відповідає відносній молекулярній масі, рівній 33,9 а.о.м. Для визначення густини газу за воднем необхідно відносну молекулярну масу газу поділити на відносну молекулярну масу водню, що дорівнює 2 а.о.м. D Н2(газу) = М газу: 2 = 33,9: 2 = 16,95.
Приклад 3. Який об’єм за нормальних умов займуть 4 × 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 × 104 Па?
Розв’язання. Для приведення об’єму газу до нормальних умов користуються загальною формулою, що поєднує закони Бойля – Маріотта та Гей-Люсака: (pV)/T = (p0V0)/T0, звідки V0 = (pVT0)/(p0T), де T0 = 273 К; p0 = 101325 Па; Т = 273 + 50 = 323 К. 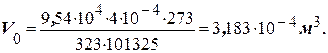
Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
Розв’язання. З умови задачі випливає, що в оксиді металу на 5 г металу припадає 9,44 – 5 = 4,44 г кисню. Відповідно до закону еквівалентів, маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
m1/m2 = E1/E2 (1.1)
Для умови нашої задачі цей закон виглядає наступним чином:
m (Me)/ m (O2) = E (Me)/ E (O2) (1.2)
Еквівалентну масу кисню визначають зі співвідношення Е = А/w, де А – маса моля атомів елемента, а w – валентність елемента, звідси Е (O2) = 16/2 = 8 г/моль. Підставивши знайдені значення в (1.2), одержимо 5/4,44 = Е (Ме)/8. Звідки Е (Ме) = (5 × 8): 4,44 = 9,01 г/моль.
Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
Розв’язання. У даній задачі одна з реагуючих речовин знаходиться в газоподібному стані, а інша – у твердому. У цьому випадку закон еквівалентів записують у такий спосіб: V/Veq = m/E, де Veq – еквівалентний об’єм газоподібної речовини. Для умови нашої задачі закон виражається у такий спосіб:
V (Н2)/ Veq (Н2) = m (Ме)/ E (Ме) (1.3)
Еквівалентним об’ємом називають об’єм газоподібної речовини, що займає за даних умов один еквівалент цієї речовини. Молярний об’єм будь-якого газу за нормальних умов дорівнює 22,4 л. Звідси еквівалентний об’єм водню (молекула якого двоатомна) Veq (Н2) = 22,4: 2 = 11,2 л. Підставляючи дані задачі в (1.3) одержимо 1,4: 11,2 = m (Ме): 28, звідки m (Ме)=(1,4 · 28): 11,2 = 3,5 г.
Приклад 6. Обчислити еквівалентні маси H2SО4 і Аl(ОH)3 у реакціях, виражених рівняннями: Н2SО4 + КОН = КHSО4 + H2О (1.4)
H2SО4 + 2КОН = К2SО4 + 2H2О (1.5)
Аl(ОH)3 + НСl = Аl(ОH)2Сl + H2О (1.6)
Аl(ОH)3 + 3НNO3 = Аl(NО3)3 + 3H2О (1.7)
Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина. Еквівалентна маса кислоти дорівнює молярній масі, розділеній на число катіонів водню, заміщених у даній реакції на інші катіони, тобто на основність кислоти: Е (к-ти) = М (к-ти)/ n, де n – основність кислоти в даній реакції. Отже, еквівалентна маса H2SО4 у реакції (1.4) дорівнює М (H2SО4)/1 = 98 г/моль, а в реакції (1.5) М (H2SО4)/2 = 49 г/моль. Еквівалентна маса основи дорівнює молярній масі, розділеній на число гідроксид-аніонів, заміщених у даній реакції на інші аніони, тобто, на кислотність основи. Отже, еквівалентна маса Аl(ОH)3 у реакції (1.6) дорівнює М (Аl(ОH)3)/1 = 78 г/моль, а в реакції (1.7) М (Аl(ОH)3)/3 = 26 г/моль.
Приклад 7. На нейтралізацію 4,9 г ортофосфорної кислоти витрачено 4 г гідроксиду натрію. Обчислити еквівалентну масу й основність кислоти в даній реакції. Написати рівняння цієї реакції.
Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
m (NaOH) /m (H3PO4) = E (NaOH) /E (H3PO4) (1.8)
Еквівалентна маса NaOH стала й дорівнює молярній масі, розділеній на число гідроксид-аніонів E (NaOH) = М (NaOH)/1 = 40: 1 = 40 г/моль.
Зі співвідношення (1.8) знаходимо еквівалентну масу H3РО4:
E (H3PO4) = 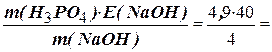 49 г/моль.
49 г/моль.
З огляду на те, що еквівалентна маса кислоти дорівнює молярній масі, розділеній на основність (n), а молярна маса H3PO4 становить 98 г/моль, знаходимо основність кислоти, тобто число атомів водню, заміщених у реакції на метал  .
.
Виходячи з того, що основність кислоти дорівнює 2, пишемо рівняння реакції H3PO4 + 2NaOH → Na2HPO4 + 2H2O
Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг × К), а хлорид цього металу містить 61,2% металу.
Розв’язання. Атомна маса металу визначається відповідно до правила Дюлонґа та Пті: атомна теплоємність (С) більшості простих речовин у твердому стані приблизно однакова для всіх елементів і дорівнює 26 кДж/(кмоль · К). Атомна теплоємність дорівнює добутку питомої теплоємності (с) простої речовини у твердому стані на його атомну масу: С = сА, відкіля А = С/с = 26: 0,23 = 113 кг/кмоль = 113 г/моль.
Відповідно до закону еквівалентів визначаємо еквівалентну масу металу (Е). Еквівалентна маса хлору 35,5 г/моль. Масова частка хлору в хлориді складає 100 – 61,2 = 38,8%. Отже, за законом еквівалентів
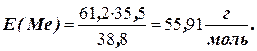
Валентність металу в хлориді n» 113: 55,91» 2,02 = 2. Отже, відносна атомна маса металу Аr = 55,91 × 2 = 111,82 а.о.м.
Приклад 9. Обчислити молярну масу ацетону, якщо маса 500 мол його пар при 87оС й тиску 96 кПа дорівнює 0,93 г. Знайдіть масу його молекули.
Розв’язання. Виразивши дані задачі в одиницях СІ (р = 9,6 × 104 Па; V = 5× ×10-4 м3; m = 9,3 × 10-4 кг; Т = 360 К) і, підставивши їх у рівняння Менделєєва –Клапейрона M = (mRT)/pV, знаходимо:
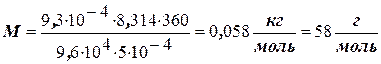 .
.
Число молекул у молі будь-якої речовини дорівнює числу Авогадро NA = = 6,02 × 1023. Отже, маса молекули речовини дорівнює молярній масі, розділеній на число Авогадро: m = М/NA = 58: (6,02 × 1023) = 9,6 × 10-23 г.
Примітки. 1) В одиницях СІ R – універсальна газова стала дорівнює 8,314 Дж/(моль × К) чи 8,314 (м3 × Па)/моль. В інших размерностях (системах) R має наступні значення 62,36 (л × мм рт. ст.)/(моль × К) чи 0,082 (л × атм.)/(моль × К) чи 1,987 кал/(моль × К). 2) 1 атм. = 101325 Па» 105 Па; 1 мм рт. ст. = 133,3 Па.
Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: С – 82,76%, Н – 17,24%.
Розв’язання. З наслідку закону Авогадро відомо, що М газу = 2 D Н2(газу), де D Н2(газу) густина газу за воднем. Таким чином, молярна маса газу
М газу = 2 · 29 = 58 г/моль.
Якщо ми позначимо формулу речовини як C x H y, то х та у – числа молів атомів відповідно карбону та гідроґену в одному молі речовини. Щоб знайти співвідношення, х та у розділимо маси (чи масові частки) на молярні маси їхніх атомів:
 = 1:2,5 = 2:5.
= 1:2,5 = 2:5.
Отже, елементарна формула могла б бути С2Н5, але, оскільки водень одновалентний, та кількість атомів його у формульній одиниці має бути парною. Отже елементарна формула повинна бути С4Н10. М (С4Н10) = 58 г/моль, що відповідає молярній масі, знайденій, виходячи з густини за воднем. Звідси випливає, що С4Н10 є істинною формулою газоподібної сполуки.
Глава 2. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Речовини поділяють на прості й складні. Прості речовини складаються з атомів одного елемента (метали, неметали та металоїди). Складними речовинами називають продукти взаємодії різних елементів. До основних класів складних речовин належать оксиди, основи, кислоти та солі.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2490; Нарушение авторских прав?; Мы поможем в написании вашей работы!