
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амальгамы
Ртуть
Щелочные металлы (Na, K, Cs, Li, Rb)
Naи Kполучают методом электролиза расплавленных гидроокисей. Хранят в виде блоков в керосине. Для использования в ЭВП и ИС отрезают в керосине (металл как воск), промывают в бензоле (2 раза) и сушат фильтровальной бумагой, очищают от Н2 и СnHm путем дистилляции. Вводят в приборы перегонкой или в маленьких стеклянных ампулах. Сухой воздух и кислород не действуют на Na, но он воспламеняется даже на мокрой фильтровальной бумаге, а с водой бурно реагирует с образованием H2 и NaOH. С ртутью Na соединяется с большим количеством тепла и света, образуя твердую амальгаму Na. Сплав NaHg плавится в зависимости от содержания Na (39,5 % Na – при 21,5 оС; 5,5 % Na – при 335 оС). В натриевые лампы высокого давления (ДНаТ) натрий дозируется в виде амальгамы (μNa:μHg = 0,65 – 0,35 – атомные доли), при этом во время работы в лампе при температуре амальгамы 700 оС РNa = 100 мм рт.ст., а РHg =1 500 мм рт.ст.
Обработка щелочных металлов (ЩМ) из-за их воспламеняемости требует тщательных мер безопасности. Необходимо пользоваться защитными очками, для тушения применять песок (Н2О не может применять- ся!). Нельзя пользоваться огнетушителями с CCl4 и СО2. Промывка ЩМ проводится в сухом подогретом (до 35 оС) эфире или бензоле, нельзя промывать в четыреххлористом углероде и трихлорэтилене. Очистка проводится методом дистилляции в вакууме. Хранить без доступа кислорода воздуха – под слоем жидкости или в откачанных стеклянных ампулах.
Свойства Hg, обеспечивающие ее широкое применение: жидкое состояние (от -36 оС) со свойствами металла (теплопроводность, электропроводность и др.); инертность к ряду агрессивных сред, в том числе к О2; способность образовывать амальгамы со многими металлами; низкое давление паров (PHg) по сравнению с Н2О – использование в качестве теплоносителя; высокий удельный вес; отсутствие смачивания стенок из стекла, некоторых металлов и ряда других веществ; высокое PHg по сравнению с другими металлами – широкое использование в источниках света и в вакуумной технике; благоприятный спектр излучения – широкое применение в плазменных источниках оптического излучения низкого и высокого (сверхвысокого) давления.
Области применения Hg: 1) металлургия: А) извлечение Au (процесс известен более 2000 лет) амальгамным методом для получения чернового золота; Б) получение Ti амальгамно-электролизным методом из TiCl4: TiCl4 + СаHg + Na2Hg → NaCl + CaCl2 + TiHg + Hg, фильтрация и дистилляция → получается титановая губка; В) получение чистых металлов и сплавов (амальгамная металлургия) с применением электролиза с ртутным катодом; Г) металлокерамика (порошковая металлургия); 2) использование Hg в химии и электрохимии (аналитическая химия, анализ малых количеств примеси, получение металлов с большой чистотой – электролизом на Hg катоде, катализатор ряда реакций, теплоноситель в виде низкопроцентных амальгам для высокотемпературной теплофикации различных процессов); 3) использование Hg в электровакуумной и электронной технике (ртутные диоды, триоды, газотроны и тиратроны, Hg-реле, Hg-насосы и др.); 4) теплоноситель в энергетике, атомной и химической промышленности; 5) в различных областях научных исследований (измерение давления и температуры, металлы и сплавы особой чистоты, изучение интерметаллических соединений, анализ кристаллографической структуры, исследование явления сверхпроводимости (HgS, HgIn, HgTl и др.); 6) в различных отраслях (медицине, фармакологии, стоматологии, физиотерапии, лечение глазных и кожных заболеваний, как антисептик, даже в сельском хозяйстве); 7) в оборонной технике (гремучая ртуть как детонатор: HgC2N2O2 → Hg + 2CO+N2 – 1 кг гремучей ртути выделяет 314 л газов).
Hg получают из киновари (HgS) путем прогрева руды в воздухе (при 500 оС) при прохождении реакции: HgS + О2 → Hg + SO2, испарившаяся Hg улавливается и конденсируется в камерах с большим количеством примесей (Pb, Bi, Zn, Sn). Затем она проходит несколько этапов очистки: 1) продувка сухим воздухом (150 – 160 оС) – очистка полностью от Pb; 2) заливка Hg чистой HCl для удаления шлама и вновь продувка горячим (160 оС) воздухом в течение 12 часов, затем пропускание через сосуд с дымящей HCl – очистка от Sn; 3) часто используется предварительная очистка Hg 10 % раствором HNO3 (потери Hg ~ 4 %) – здесь важно получить большой контакт Hg с жидкостью (струя Hg разбивается о стенку, о кольца Рашига и др. [1, т. 1]; 4) электролитическая очистка Hg; 5) перегонка Hg в вакууме (нагрев до 180 – 200 оС) – получается Hg высокой чистоты; 6) перегонка Hg в вакууме (нагрев до 500 оС) – чистота Hg ниже, чем по п.5, но производительность процесса выше.
Химические свойства Нg: 1) Hg не взаимодействует с сухим воздухом (не содержащем S), начинается взаимодействие с воздухом только при 350 оС; 2) образование тонких черных пленок на стекле, в том числе кварцевом, в ртутных разрядных приборах свидетельствует о наличии в них О2; 3) Hg с большинством металлов образует амальгамы (растворяются в Hg): Zn, Sb, Pb, Cd, Ag, Mg, чистая Cu, Al, Pt, щелочные и щелочноземельные металлы, Na и К образуют амальгамы с большим выделением тепла, может быть воспламенение при наличии О2 (приготовление таких амальгам необходимо осуществлять в защитной атмосфере Ar в кварцевых сосудах, охлаждаемых водой); 4) Fe и W не взаимодействуют с Hg; 5) Hg растворяется в концентрированных HCl, H2SO4 и царской водке, остальные кислоты с Hg не взаимодействуют.
Меры предосторожности при работе с Hg.
Проникновение Hg в организм человека приводит к его отравлению, которое выражается в повышении слюнотечения, ослаблении памяти, общем утомлении, опухании десен, выпадении зубов, заболеваниях почек и печени [9]. При попадании Hg в пищеварительный тракт ее поглощение незначительно вследствие образования каломели, а вдыхание паров Hg очень опасно – именно попадание Hg в органы дыхания приводит к ее поглощению и переносу кровью в другие органы.
Одной из мер предосторожности является недопущение разлива Hg, отсутствие открытых поверхностей Hg и хранение ее в толстостенных сосудах под слоем парафинового масла или йодированного угля. Столы, на которых проводятся работы со Hg, должны быть деревянными и иметь предохранительные бортики для предотвращения скатывания капелек Hg на пол. Большие сосуды с Hg должны быть окружены защитной оболочкой. Выхлопные газы вакуумных систем с парортутными насосами должны поступать в системы очистки от паров Hg, а не в помещение откачного участка (зала). В случае попадания Hg в помещение должна быть проведена его демеркуризация: все капельки Hg должны быть собраны с помощью ватного томпона, смоченного крутым раствором марганцовки (марганцово-кислого калия – KMnO4), а поверхности возможного попадания Hg протерты этим же раствором или раствором хлорного железа; помещение должно быть хорошо проветрено.
Качественное определение наличия Hg в помещении: активированный желтый порошок SeS2 нанести тонким слоем на бумагу и оставить его на несколько часов – при наличии паров Hg в помещении (при давлении 10-4 – 10-5 мм рт.ст.) порошок приобретает черный цвет.
Защитные мероприятия против отравления ртутью: хорошее проветривание помещения; рациональное питание; тщательная общая гигиена; недопустимость приема пищи и курения в помещении, в котором ведутся работы с Hg. В атмосфере с парами Hg необходимо применять защитные маски с фильтрами из активированного угля с примесью 5 % йода.
Введение Hg в связанном состоянии в ЭВП или ИС: 1) в виде амальгам (высокотемпературных и низкотемпературных); 2) в виде порошка меркурида титана (γ фаза Ti3Hg); в виде порошка, приваренного на подложку из феррохромистой стали; в виде спрессованного штабика в негерметичной ампуле; 3) в виде порошка НgO или спрессованного из него штабика и газопоглотителя для поглощения кислорода, выделяющегося при разложении НgO.
Амальгама – металлическая система, одним из компонентов которой является Hg (ранее применявшееся определение – сплав Hg с металлом – не не раскрывало характера взаимодействия).
Растворимость металлов (Ме) в Hg: 1) выше 10 % – Tl; 2) от 1 до 10 % – Cs, Rb, Cd, Zn, In, Pb, Bi; 3) от 0,1 до 1 % – Na, K, Mg, Ca, Sr, Ba, Sn; 4) от 0,01 до 0,1 % – Li, Ag, Au, Th; 5) от 0,001 до 0,01 % – Cu, Al, Mn; 6) крайне нерастворимы – Be, Ge, Ti, Zr, As, Sb, V, Ta, Cr, Mo, W, U, Fe, Ni, Co. Растворимость Ме в Hg связана с межатомными взаимодействиями атомов Ме и Hg и разрушением вследствие этого кристаллической решетки Ме. Природа и энергия межатомной связи в кристаллической решетке Ме имеют определяющее значение. Здесь значительное влияние оказывают термодинамические и физические свойства Ме (теплота плавления, испарения, сублимации, твердость), которые зависят от положения Ме в периодической системе Менделеева.
Образование интерметаллических соединений со скачкообразным изменением свойств: с повышенной температурой плавления (MgHg, NaHg, KHg, LiHg и др.); с полупроводниковыми свойствами (HgS, HgSe, HgTe и др.); со сверхпроводящими свойствами (HgIn, HgSn, HgCd, KHg3, NaHg4 и т.д.).
Типы связей в интерметаллических соединениях: 1-й тип связи – молекулярная связь (в результате поляризации атомов под действием разносимметричных зарядов – силы электростатической природы – Ван-дер-Ваальса); 2-й тип связи – ионная (или полярная) – атомы в виде ионов находятся в кристалле (разноименные заряды – притяжение), например, NaCl; 3-й тип связи – ковалентная или гомополярная – однородные атомы соединяются так, что внешние орбиты составляют единую систему, включающую 2 электрона, вращающихся вокруг двух элементов: H2, N2, O2, Cl2, распад ковалентной связи дает нейтральные атомы; 4-й тип связи – металлическая (в металлах и сплавах) – насыщение валентности металла происходит за счет обобщения всех имеющихся электронов, что обеспечивает высокую электрическую проводимость и большую степень деформации.
Классификация амальгам (А): тип 1 – А с Ме, не растворимыми в ртути (Fe, Ni, Co, Mn, Cr, Al) – получаются электролитическим путем при потенциалах, более отрицательных по сравнению с чистыми Ме; тип 2 – А «цинкового типа» с Ме, хорошо растворимыми в Hg (Zn, Cd, Tl, Pb, Sn, In, Bi) – получаются электролитическим путем на твердых катодах при потенциалах, близких к потенциалу Ме; тип 3 – А «натриевого» типа, дающие с Hg химические соединения (Na, Li, K, Rb, Cs, Mg и редкие Ме). Амальгамы по типу 1 имеют частицы с размерами 2 – 5 мкм, образующие суспензию в Hg. Крупные частицы амальгам по типу 1 получаются в автоклавах при повышенной температуре методом прямого контакта с Hg (U, Th, Ti, Zr, Al и др.). Амальгамы по типу 2 – гомогенные жидкие растворы при комнатной температуре для высокорастворимых Ме, а для малорастворимых Ме – амальгамы в виде пастообразных суспензий частиц Ме в Hg или интерметаллических соединений в насыщенном растворе Hg.
Способы получения амальгам: непосредственный контакт Ме с Hg при комнатной или повышенной температуре – процесс начинается со смачивания ртутью Ме, при этом кинетика зависит от состояния поверхности и дисперсности Ме (особую роль играет окисная пленка, для Ме, на которых она легко образуется, лучше процесс проводить в вакууме или в среде инертного газа); метод электролиза – может применяться для любых А, а для хорошо растворимых Ме могут быть получены «истинные» А – растворы Ме в Hg.
Применение амальгам в источниках света: 1) высокотемпературные А (оптимальное РHg = 6∙10-3 мм рт.ст. обеспечивается при температуре 60 – 100 оС) на основе In или Cd (более 50 %) с добавлением Pb, Sn, Bi, Zn при содержании Hg 10 – 30 % (% весовые) – только In и Cd снижают РHg по сравнению с таковым для чистой Hg, они имеют в соединениях с Hg отрицательное отклонение от закона Рауля; 2) низкотемпературные А (оптимальное РHg = 6∙10-3 мм рт.ст. обеспечивается при температуре 38 – 42 оС) на основе Pb, Sn, Bi, Zn, возможно, с небольшими добавками In или Cd; 3) А на основе Na (см. выше пункт по щелочным Ме) для ламп ДНаТ. В амальгамах по п.1 добавление Pb, Sn, Bi, Zn делается для управления такими свойствами, как пластичность (хрупкость), температура размягчения и плавления. Они применяются для всех типов трубчатых ЛЛ, в том числе компактных (КЛЛ) с тяжелым тепловым режимом (повышенной мощности или работающих в закрытых светильниках). Амальгамы по п.2, имеющие положительное отклонение от закона Рауля, применяются для повышения экологических свойств (у производителей и у потребителей) всех типов ЛЛ и КЛЛ, эксплуатирующихся в открытых светильниках и имеющих наиболее холодную зону с температурами 30 – 50 оС. Амальгамы по п.3 изготавливаются под защитным слоем нейтральной жидкости, в инертном газе или вакууме, так же они должны и храниться, иначе металлы (особенно в жидкой А) могут целиком перейти в окислы или гидраты.
Закон Рауля (применим к разбавленным растворам) – давление пара раствора ниже давления пара чистого растворителя на величину, пропорциональную концентрации растворенного вещества, и определяется уравнением (РА – РАS) / РА= хВ = nB / (nA+ nB), где РА, РАS – давление паров чистого растворителя и раствора, хВ – молярная доля растворенного вещества в растворе, nA и nB – количество молей растворенного вещества и растворителя соответственно. Так как хА = nA/(nA+nB), то aA = РАS / РА = хА, где aA – активность вещества амальгамы в растворе.
Для амальгам закон Рауля можно записать так: 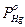 = xHg PHg, где xHg – концентрация Hg в амальгаме,
= xHg PHg, где xHg – концентрация Hg в амальгаме, 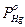 и PHg – давление пара Hg над амальгамой и над чистой Hg соответственно. Для реальных растворов
и PHg – давление пара Hg над амальгамой и над чистой Hg соответственно. Для реальных растворов 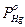 = аHg, где аHg – активность Hg в амальгаме – это термодинамическая характеристика, которая является производной для определения других термодинамических характеристик (свободной энергии, энтропии, энтальпии). При аHg < 1 можно получать
= аHg, где аHg – активность Hg в амальгаме – это термодинамическая характеристика, которая является производной для определения других термодинамических характеристик (свободной энергии, энтропии, энтальпии). При аHg < 1 можно получать 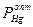 при температурах > 38 – 42 оС.
при температурах > 38 – 42 оС.
Требования к амальгамообразующим металлам: способность образовывать А, в которых аHg < 1; низкое давление собственного насыщенного пара; не вступать в химическое взаимодействие с материалами ЛЛ как при изготовлении ЛЛ, так и при их работе; иметь необходимую температуру плавления, пластичность (твердость), химическую устойчивость в процессе изготовления, интенсивность амальгамообразования (для А, образующихся в ЛЛ после их изготовления); приемлемая стоимость. Анализ данных по растворимости Ме в Hg, диаграмм состояний Ме – Hg и технологии получения А позволяет рекомендовать следующие наиболее приемлемые для получения А металлы: Zn, Cd, In, Tl, Sn, Pb, Bi.
Термодинамические свойства бинарных систем: Zn – Hg: положительное отклонение от закона Рауля в системе Zn – Hg объясняется ассоциацией атомов Zn по уравнению: 2Zn = Zn2. При хZn = 0,3 и t = 335 оС значение энтальпии смешения максимальное (430 Дж/(г · ат)); Cd – Hg: активность Cd и Hg в жидком состоянии показывает отрицательное отклонение от закона Рауля ввиду взаимодействия компонентов с образованием интерметаллических соединений. Значение tопт увеличивается с ростом хCd в А (при 48 % вес. Cd – 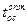 увеличивается c 25 до 45 оС); In – Hg: система характеризуется образованием ряда интерметаллических соединений в твердом состоянии. Активность In и Hg проявляется отрицательным отклонением от закона Рауля (при хHg от 0,05 до 0,6 – отрицательное отклонение с максимальным значением при хHg = 0,2,
увеличивается c 25 до 45 оС); In – Hg: система характеризуется образованием ряда интерметаллических соединений в твердом состоянии. Активность In и Hg проявляется отрицательным отклонением от закона Рауля (при хHg от 0,05 до 0,6 – отрицательное отклонение с максимальным значением при хHg = 0,2, 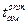 при хHg = 0,1 – 0,2 не зависит от хHg); Tl – Hg: изотермы активности Tl и Hg показывают незначительное отрицательное отклонение от закона Рауля; Sn – Hg: у жидких сплавов системы Sn – Hg имеется существенное положительное отклонение от закона Рауля (890 Дж/(г·ат) при хSn = 0,3); Pb – Hg: активность Hg (аHg) характеризуется положительным отклонением от закона Рауля во всей области составов. Активность Pb (aPb) при низком содержании Pb имеет положительное отклонение, а для составов, богатых Pb, наблюдается значительное отрицательное отклонение – это объясняется существованием в твердом состоянии интерметаллического соединения Pb2Hg, оказывающего влияние на свойства жидких амальгам; Bi – Hg: для 321 оС при хHg = 0,6 проявляется положительное отклонение от закона Рауля, а при хHg = 0,4 – поведение Bi в амальгаме соответствует идеальному раствору.
при хHg = 0,1 – 0,2 не зависит от хHg); Tl – Hg: изотермы активности Tl и Hg показывают незначительное отрицательное отклонение от закона Рауля; Sn – Hg: у жидких сплавов системы Sn – Hg имеется существенное положительное отклонение от закона Рауля (890 Дж/(г·ат) при хSn = 0,3); Pb – Hg: активность Hg (аHg) характеризуется положительным отклонением от закона Рауля во всей области составов. Активность Pb (aPb) при низком содержании Pb имеет положительное отклонение, а для составов, богатых Pb, наблюдается значительное отрицательное отклонение – это объясняется существованием в твердом состоянии интерметаллического соединения Pb2Hg, оказывающего влияние на свойства жидких амальгам; Bi – Hg: для 321 оС при хHg = 0,6 проявляется положительное отклонение от закона Рауля, а при хHg = 0,4 – поведение Bi в амальгаме соответствует идеальному раствору.
|
|
Дата добавления: 2014-11-25; Просмотров: 1168; Нарушение авторских прав?; Мы поможем в написании вашей работы!