
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественное определение. Natrium bromatum М.м
|
|
|
|
Получение.
NaBr
Натрия бромид
Natrii bromidum
Natrium bromatum
| М.м. 102,90 |
Распространен в виде минеральных источников в небольшом количестве.
1) Заводской способ
Из бромида закисно-окисного железа (Fe3Br8) → FeBr2 + 2FeBr3 и карбоната натрия.
Fe3Br8 + 4Na2Co3 + 4H2O = 8NaBr + Fe(OH)2↓ + 2Fe(OH)3↓ + 4CO2↑
Натрия бромид очищают перекристаллизацией.
2) Лабораторный способ.
Путем пропускания брома через горячий раствор натрия гидроксида до насыщения.
6NaOH + 3Br2 = NaBrO3 + 5NaBr + 3H2O
| Br2 + 2e → 2Br- | ||
| -10 ē | ||
| Br2 + 12OH- → 2BrO3- + 6H2O |
6Br2 + 12OH- → 10Br- + 2BrO3- + 6H2O
3Br2 + 6OH- → 5Br- + BrO3- + 3H2O
NaBrO3 восстанавливают до натрия бромида с помощью древесного угля.
2NaBrO3 + 3C = 2NaBr + 3CO2↑
| Br+5 + 6ē → Br- | ||
| C0 -4 ē → C+4 |
Описание. Белый кристаллический порошок без запаха соленого вкуса. Гигроскопичен.
Растворимость. Растворим в 1,5 ч воды и в 10 ч спирта.
Подлинность. Препарат дает характерные реакции на натрий и на бромиды.
Прозрачность и цветность раствора. Должен быть прозрачным и бесцветным.
Щелочность. К раствору препарата прибавляют 2 капли 0,1М раствора соляной кислоты, раствор не должен окрашиваться в розовый цвет ни на холоду, ни при кипячении от прибавления 1 капли фенолфталеина.
Йодиды. Раствор препарата не должен окрашиваться в синий цвет от прибавления нескольких капель хлорида железа (III) и раствора крахмала.
2NaJ + 2FeCl3 → 2FeCl2↓ + J2 + 2NaCl
1) Аргентометрия по Мору (см. натрия хлорид, калия хлорид).
2) Аргентометрия по Фольгарду.
NaBr + AgNO3 = AgBr↓ + NaNO3
AgNO3 + NH4CNS = AgCNS↓ + NH4NO3
Fe(NH4)(SO4)2 + 3NH4CNS = Fe(CNS)3 + 2(NH4)2SO4
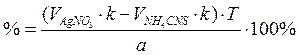
3) Аргентометрия по Фаянсу (индикатор – эозинат натрия).
4) Ионообменная хроматография.
5) Внутриаптечный контроль (ВАК) – рефрактометрия.
Хранение. В хорошо укупоренной таре, предохраняющей от действия света, в сухом месте.
Применение. Препараты брома обладают способностью усиливать процессы торможения в коре головного мозга, поэтому применяются как успокаивающие средства при невралгии, неврозах, истерии, повышенной раздражительности, бессоннице, гипертонической болезни, эпилепсии.
При длительном применении внутрь и внутривенно может развиться бромизм (насморк, кашель, общая вялость, кожная сыпь).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 4426; Нарушение авторских прав?; Мы поможем в написании вашей работы!