
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
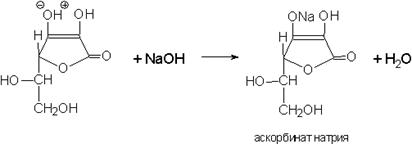
Химические свойства. 1. Кислота аскорбиновая – одноосновная кислота
|
|
|
|
1. Кислота аскорбиновая – одноосновная кислота. Кислотный характер обусловлен водородом в OH-группе в 3 положении.
2. Легко окисляется благодаря наличию ендиольной группировки, что обуславливает ее химические свойства и физиологические активы.
Благодаря подвижности H+, витамин C легко окисляется в две стадии:
2.1. Обратимое окисление до дегидроаскорбиновой кислоты.
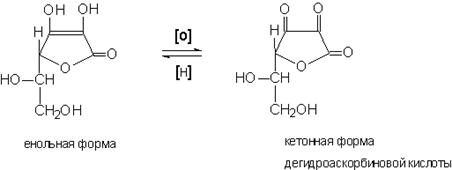
2.2. В водной среде процесс идет дальше до разложения дегидроаскорбиновой кислоты и теряет физиологическую активность. Чтобы задержать вторую стадию окисления, в растворы аскорбиновой кислоты для инъекций добавляют стабилизаторы (NaHSO3), хранить растворы нужно в темном месте.
Подлинность.
Все реакции подлинности основаны на восстановительных свойствах аскорбиновой кислоты.
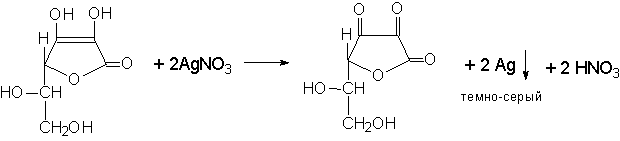
1. С раствором нитрата серебра образуется темно-серый осадок свободного серебра.
2. При прибавлении к раствору препарата раствора 2,6 – дихлорфенолиндофенола синяя окраска последнего исчезает.
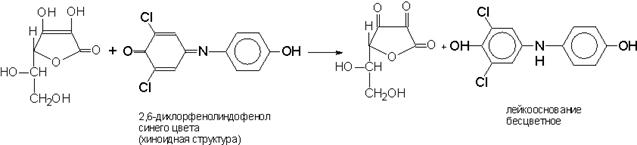
3. Кроме этих реакций можно провести ряд химических реакций, основанных на восстановительных свойствах витамина C.
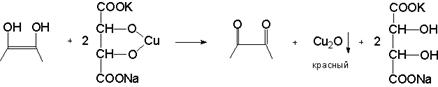
3.1. С реактивом Фелинга.
3.2. С раствором йода (обесцвечивание).

3.3. С раствором перманганата калия.
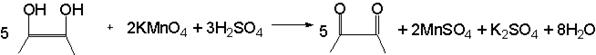
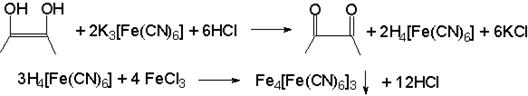
3.4. С феррицианидом калия в присутствии соляной кислоты и хлорида железа (III) → образуется берлинская лазурь синего цвета.
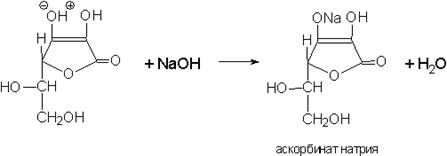
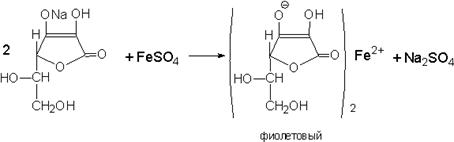
4.Реакция солеобразования за счет H в OH-группе в 3 положении.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 6817; Нарушение авторских прав?; Мы поможем в написании вашей работы!