
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амиды сульфаниловой кислоты
|
|
|
|
Количественное определение.
Подлинность.
Тримекаин
Trimecainum
Trimecaini hydrochloridum
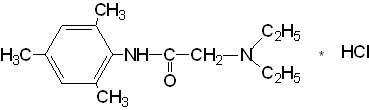
Диэтиламино - 2,4,6 - триметилацетанилида гидрохлорид
Свойства: белый кристаллический порошок, легко растворим в воде и спирте, нерастворим в эфире.
1. После кислотного гидролиза проводят реакцию на первичную ароматическую аминогруппу (диазотирование и образование азокрасителя).
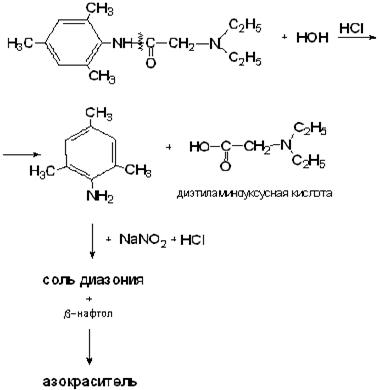
2. Реакция на хлориды.
3. На предметное стекло наносят 0,01 препарата, прибавляют 1к. раствора серной кислоты (1:5), 1к. 0,1М бихромата калия, перемешивают. Через 5-10мин. по краям капли появляются кристаллы в виде игл, собранных в пучки или сеточки (pH 4,4 - 6,1).
1. По хлороводороду - нейтрализация. Метод алкалиметрии с индикатором - фенолфталеином.
2. Метод аргентометрии (индикатор - хромат калия).
Хранение. В хорошо укупоренной таре.
Применение. Местноанестезирующее средство, действует быстрее, сильнее, продолжительнее, чем новокаин. Применяется для инфильтрационной и проводниковой анестезии.
Сульфаниламидные препараты.
Общая характеристика.
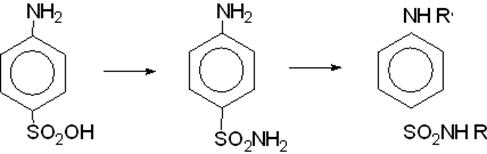
| сульфаниловая кислота | амид сульфаниловой кислоты | сульфаниламидные препараты |
Сама кислота не является лекарственным веществом, её амид (стрептоцид) является лекарственным препаратом и источником получения сульфаниламидных препаратов.
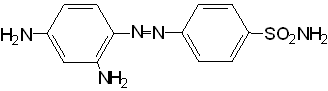
Открыты сульфаниламидные препараты были случайно, связано это с текстильной промышленностью, когда французский химик Гельмо (1909 г.) синтезировал n - аминосульфамид как источник для получения красителя по реакции диазотирования и сочетания с β- нафтолом.
После того, как стало известно, что красители проявляют антимикробную активность, немецкий ученый Домаск (1932) получил азокраситель - пронтозил, который был эффективен при стрептококковых инфекциях.
Это открытие послужило началом нового этапа в развитии химиотерапии.
Основной задачей химиотерапии является изыскание средств борьбы с инфекционными заболеваниями.
Химиотерапевтическими средствами называют такие вещества, которые избирательно действуют на патогенные микроорганизмы и почти не действуют в тех же концентрациях на макроорганизм.
Впервые термин химиотерапия ввел немецкий ученый Эрлих (1891), который предложил применять метиленовую синь для лечения малярии. Основные положения химиотерапии сформулировал Д.Л.Романовский (1891г.).
Сульфаниламидные препараты обладают высокой активностью при лечении заболеваний, при которых раньше наблюдалась большая смертность (крупозное воспаление легких, менингит, газовая гангрена).
В нашей стране создание отечественных сульфаниламидных препаратов относится к 1935 - 1936гг. (первые работы во ВНИХФИ под руководством химика-органика Магидсона).
Первым сульфаниламидным препаратом, созданным советскими химиками (Магидсон, Рубцов) был красный стрептоцид, который по химической структуре близок к зарубежному пронтозилу (пронтозил * HCl).
Затем было установлено, что в организме красный стрептоцид (пронтозил) расщепляется с образованием сульфаниламида (высокоэффективное в терапевтическом отношении вещество) и 1,2,4 - триаминобензола (токсичный, физиологически неактивный продукт).
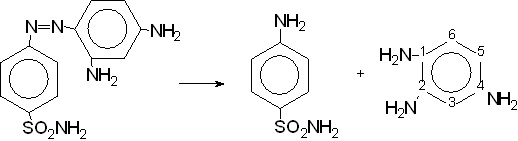
| n-аминобензолсульфамид | 1,2,4 - триаминобензол |
Поэтому пришлось отказаться от красного стрептоцида, все внимание сосредоточить на сульфаниламиде.
В нашей стране n - аминобензолсульфамид был введен в 1936г. под названием "белый стрептоцид" в отличие от ранее созданного красного и является родоначальником всей группы сульфаниламидных препаратов.
В 40 - е годы были созданы такие сульфаниламидные препараты: стрептоцид, стрептоцид белый, сульфацил, норсульфазол, сульгин, сульфадимезин, этазол, уросульфан, фталазол и др.
Но к 1944 - 1945гг. с появлением первых антибиотиков (пенициллин, стрептомицин, грамицидин), открывших новый этап в химиотерапии, интерес к сульфаниламидам снизился. Этому способствовало то, что сульфаниламиды действуют непродолжительно, быстро выводятся из организма, поэтому дозы их велики (2,0 - 7,0). У микроорганизмов вырабатывается устойчивость к сульфаниламидам, а ещё большее увеличение доз их приема приводит к повышению их токсичности (камни в почках - кристаллурия, аллергия, изменения в крови - лейкопения и др.).
В связи с этим началась работа по созданию сульфаниламидов пролонгированного действия, которые отличаются строением радикала. Были получены сульфапиридазин, сульфамонометоксин, сульфадиметоксин, фтазин.
Эти препараты создают высокую концентрацию в крови и долго задерживаются в организме, что уменьшает побочные явления.
Обычно сульфаниламиды непродолжительного действия назначают до 6,0 в сутки (прием через каждые 4 ч). Препараты пролонгированного действия назначают в первые сутки 1,0, а затем по 0,5 в день.
Одним из новых и наиболее совершенных сульфаниламидов является сульфален - препарат сверхдлительного действия.
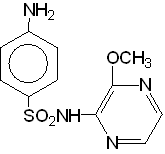
(6 - метоксипиразин)
Период полувыведения этого препарата из крови 65ч. (при хронических заболеваниях назначают 1,0 в течение 7-10 дней, а при острых инфекциях 0,2 ежедневно).
Схема синтеза сульфаниламидов
I. Получение хлорангидрида ацетилированной сульфаниламидной кислоты (общая для всех сульфаниламидов).
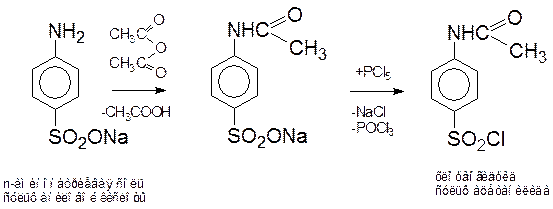
II. Получение соответствующего аминопроизводного R-NH2 (индивидуально для каждого сульфаниламида).
III. Конденсация хлорангидрида сульфаниловой кислоты с аминопроизводным.
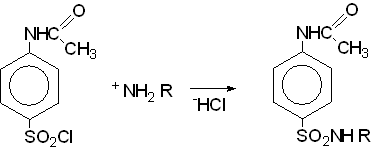
IV. Омыление ацетильной группы.
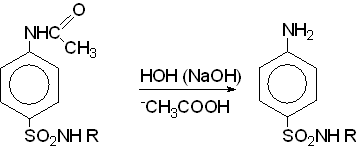
V. Введение радикала.
Одновременно с синтезом сульфаниламидов проводилась работа по установлению связи между химическим строением и их физиологическим действием.
Основные закономерности.
1. Физиологическая активность сульфаниламидов обусловлена наличием сульфанилового радикала в молекуле.
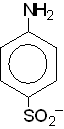
2. Перемещение NH2 группы в другие положения (из 4 положения) ароматического ядра приводит к полной потере физиологического действия.
3. Любое производное сульфаниламида с замещенной аминогруппой в положении 4 может быть физиологически активным лишь в том случае, если в организме будет проходить гидролиз с образованием свободной NH2 группы.
4. Введение в ароматическое ядро дополнительных заместителей либо уничтожает, либо уменьшает физиологическую активность.
5. При введении различных радикалов в сульфаниламидную группу физиологическая активность может меняться.
6. Для длительного действия существенное значение имеет наличие в молекуле -OCH3 метоксильных групп (-OCH3 определяет более высокий процент связывания сульфаниламидов с белками плазмы, что и обуславливает длительность действия препарата).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 6478; Нарушение авторских прав?; Мы поможем в написании вашей работы!