
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація неорганічних речовин
|
|
|
|

Вплив зовнішніх умов на речовини призводить до протікання в них різноманітних процесів. Дані процеси можна розподілити на кілька видів:
- фізичні процеси (нагрівання, випаровування, плавлення, охолодження, конденсація тощо) не змінюють будови атомів або молекул, з яких складається дана речовина;
- хімічні процеси змінюють будову атомів і молекул, з яких складаються речовини, що реагують, і в результаті утворюються нові речовини з новими хімічними і фізичними властивостями. Хімічні процеси і є хімічними реакціями, які умовно зображують за допомогою хімічних рівнянь;
- фізико-хімічні процеси (наприклад, розчинення) є проміжними між фізичними і хімічними процесами. Вони, як правило, не викликають радикальних змін хімічних властивостей речовин, що беруть у них участь.
М. В. Ломоносов у XVIII ст. розвинув атомно-молекулярні уявлення і вперше ввів їх у хімію. Сучасна хімія почалася з розуміння й прийняттям більшістю вченихосновних положень внутрішньої будови речовини, уявлення про атоми як носіїв властивостей елементів та про молекули як носіїв хімічних властивостей різних речовин. Дані уявлення об'єднуються атомно-молекулярним вченням і допомагають установити фундаментальні закони, які прийнято вважати основними законами хімії:
І. Закон збереження маси (Михайло Васильович Ломоносов, 1748 р.):
Маса речовин, що вступають у хімічну реакцію, дорівнює масі речовин, що утворюються внаслідок реакції.
ІІ. Закон сталості складу (Жан-Луі Пруст, 1801 р.):
Кожна речовина, незалежно від умов і способів її добування, має сталий склад.
ІІІ. Закон об’ємних відношень (Гей-Люсак, 1808 р.):
Об’єми газів, що вступають в реакцію, відносяться один до одного і до об’ємів добутих газоподібних продуктів як невеликі цілі числа.
IV. Закон Авогадро (Амедео Авагадро, 1811 р.):
В однакових об’ємах різних газів за однакових умов (температури і тиску) міститься однакове число молекул.
Перший наслідок: Один моль будь-якого газу за однакових умов займає однаковий об’єм. За нормальних умов (Т =273 К, Р =101,325 КПа) об’єм 1 моль будь-якого газу дорівнює 22,4 л і містить 6,02·1023 молекул.
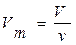 Другий наслідок: Молярний об’єм газу – це величина, що дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу, тобто:
Другий наслідок: Молярний об’єм газу – це величина, що дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу, тобто:
,
де V – молярний об’єм газу, м3/моль (л/моль); ν – кількість речовини газу, моль; V – об’єм газу, м3.
Другий наслідок дозволяє ввести поняття відносної густини першого газу за другим:
 ,
,
де D — відносна густина, що показує, у скільки разів перший газ важчий за другий за однакових умов.
Найчастіше використовують відносну густину газу за воднем. Тоді:

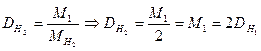
Таким чином, можна розрахувати відносну густину за будь-яким газом.
V. Закон еквівалентів (Джон Дальтон, 1803 р.):
Маси речовин, які вступають у реакцію та утворюються після неї, пропорційні їхнім еквівалентам.
Однією з важливих характеристик атома є його маса. Абсолютні значення мас атомів елементів є дуже малими величинами і користуватися ними незручно. Тому в розрахунках застосовують відносні значення мас атомів.
Відносною атомною масою (Ar) називається число, що показує, у скільки разів маса одного атома елемента більша за 1/12 маси атома Карбону.
Відносною молекулярною масою (Mr) називається число, що показує, у скільки разів маса даної молекули більша за 1/12 маси молекули вуглецю.
Кількість речовини (ν) — це визначене число будь-яких структурних одиниць (атомів, молекул, йонів тощо). Одиниця виміру кількості речовини — моль. В 1 моль речовини число структурних частинок дорівнює 6,02·1023, тобто стільки ж, скільки міститься в 0,012 кг Карбону. Це число визначене експериментально і називається сталою Авоґадро:
NА = 6,02·1023 моль-1
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1430; Нарушение авторских прав?; Мы поможем в написании вашей работы!