
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Складання рівнянь окисно-відновних реакцій
|
|
|
|
Визначить ступінь окиснення елементів, що входить до складу речовин.
Визначить ступінь окиснення елементів, що входить до складу речовин.
Визначить ступінь окиснення елементів, що входить до складу реагуючих речовин.
Окиснення - це процес, за якого атоми віддають електрони,а відновлення - це процес, за якого атоми приєднують електрони.Процеси віддавання і приєднання електронів відбуваються одночасно: у цьому разі одні сполуки окиснюються, а інші відновлюються.Речовини, у складі яких є атоми, що віддають електрони, називають відновниками, а реагенти, що приймають електрони - окисниками. Окисник, приймаючи електрони, відновлюється, а відновник окиснюється. Кількість електронів, які приймає окисник, дорівнює кількості електронів, які віддає відновник. Процес окиснення супроводжується збільшенням ступеня окиснення, а процес відновлення - зменшенням.
Про окисно-відновні властивості атомів та сполук, що їх містять, можна судити на основі Періодичної системи елементів Д.І.Менделєєва. Відомо, що за номером групи можна визначити як найнижчий так і найвищий ступінь окиснення. Наприклад, елемент Сульфур знаходиться у шостій групі Періодичної системи. Номер групи показує, що атом Сульфуру має найвищий ступінь окиснення +6, а найнижчий -2. Відомі також сполуки, як сульфатна кислота H2SO4 та її солі, в яких атом сірки має проміжний ступінь окиснення +4. Атоми в проміжному ступені окиснення можуть бути як окисниками так і відновниками одночасно.
До найважливіших відновників належать: метали, гідроген, вугілля, СО, Н2S, SO2, H2SO3, HJ, HB, HCl, ZnCl2, MnSO4, CrCl3, NH3, N2H4, NO, H3PO3, альдегіди, спирти, мурашина та щавлева кислоти, глюкоза.
До найактивніших окисників відносять: KnMnO4, K2CrO4, O2, O3, H2SO3 (конц), Н2О2, HNO3, Ag2О, РвО2, галогени, йони Аu3+, Ag+, (NH4)2S2O8, гіпохлорити NaClO, царська водка.
Правильно складене рівняння реакції є виразом закону збереження маси речовини. Це означає, що число одних і тих самих атомів у вихідних речовинах та продуктах реакції повинно бути однаковим. Повинні зберігатися і заряди: сума зарядів вихідних речовин завжди повинна дорівнювати сумі зарядів продуктів реакції.
При складанні рівнянь необхідно додержуватись певного порядку:
1. проставити над елементами у речовинах ступені окиснення і визначити, що є окисником, а що відновником. Якщо у рівнянні відсутня права частина, тобто не записані продукти реакції, треба їх дописати, виходячи із можливих варіантів зміни ступенів окиснення окисника і відновника;
2. скласти схему йонно-електронного балансу, тобто виписати елементи окисника і відновника і написати напівреакції їх окиснення і відновлення;
3. знайти найменше спільне кратне число електронів, що приймають участь в окисно-відновному процесі, та визначити коефіцієнти, які повинні стояти у рівнянні перед речовинами, що змінили ступені окиснення;
4. підібрати коефіцієнти для речовин, в яких не відбулося змін ступеню окиснення;
5. перевірити правильність запису рівняння, підрахувавши кількість атомів у лівій та правій частинах рівняння - вони повинні бути однаковими.
Найчастіше при складанні ОВР використовують метод електронного балансу та йонно-електронний метод (або метод напівреакцій). Вказані методи ґрунтуються на положенні, що в окисно-відновних процесах загальна кількість електронів, які віддає відновник, дорівнює загальній кількості електронів, які приєднує окисник.
При складанні рівнянь окисно-відновних процесів найчастіше використовується метод електронного балансу, що полягає у визначенні кількості електронів, які переміщуються від відновника до окисника і зрівнянні їх загальної кількості.
Розглянемо послідовність етапів складання рівнянь за методом електронного балансу:
1. записують у молекулярному вигляді вихідні речовини і продукти реакції, Наприклад:
KMnO4 + HCI→KCI + MnCI2 +CI2 +H2O;
2. зазначають ступені окиснення атомів, які їх змінили:
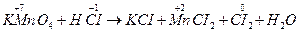 ;
;
3. записують електронні рівняння процесів окиснення і відновлення (баланс електронного обміну):
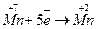 5 2 Відновлення
5 2 Відновлення
 2 5 Окиснення
2 5 Окиснення
З урахуванням того, що кількість відданих відновником електронів повинна дорівнювати кількості електронів, приєднаних окисником, знаходять спільний множник для двох електронно-йонних рівнянь. Ці множники підбирають за правилом знаходження найменшого спільного кратного, у нашому прикладі таким спільним множником буде 10. Отже, множники 2 і 5 є коефіцієнтами відповідно, біля йонів Мангану і Хлору в рівнянні окисно-відновної реакції.
Якщо біля атому елементу є індекс (наприклад, хлор СІ2), то його враховують, і коефіцієнт ставлять спочатку перед цією речовиною.
Якщо один і той же елемент і змінює, і не змінює ступінь окиснення, то спочатку коефіцієнт ставлять там, де ступінь окиснення змінився:
KMnO4 + HCI→KCI + 2MnCI2 +5CI2 +H2O;
4. урівнюють кількість атомів металів, неметалів, кислотних залишків, Гідрогену, які не змінили ступеню окиснення; стрілку в рівняння замінюють на знак рівності:
2KMnO4 + 16HCI = 2KCI + 2MnCI2 +5CI2 + 8H2O;
5. правильність підбору коефіцієнтів перевіряють за кількістю атомів Оксигену: 2 · 4 = 8.
У тих випадках, коли кількість елементів, що змінюють ступінь окиснення більше, ніж 2, визначають загальну кількість електронів, яку віддав відновник, чи загальну кількість електронів, яку приймає окисник, і надалі продовжують аналогічно. Наприклад:

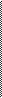
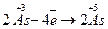 28 3
28 3
 84
84
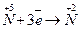 3 28
3 28
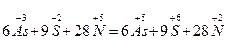 або
або

Йонно-електронний метод, або метод напівреакцій, відображає сутність ОВР, які відбуваються у розчинах електролітів і ґрунтуються на складанні напівреакцій процесів окиснення й відновлення з наступним підсумовуванням їх у загальне окисно-відновне рівняння. У разі складання рівнянь цим методом необхідно пам’ятати наступні правила:
1. записують в йонному вигляді відновник, окисник та продукти їх окиснення та відновлення. Сильні електроліти записують у вигляді йонів, наприклад, SO42-, NO3-, NO2-, SO32-, CIO4-, CI-, Fe3+. Слабкі електроліти, осади та гази, позначають у вигляді молекул: H2O, SO2, SO3, CO2, NH3, H2, NO2, Fe2O3, Ag2O, Cu2S;
2. якщо вихідна речовина містить більше атомів Оксигену, ніж продукти реакції, то вивільнений Оксиген зв’язується в кислих розчинах йонами гідрогену Н+ з утворенням води, а в нейтральних та лужних – у гідроксид-йони;
3. якщо вихідна речовина містить менше атомів Оксигену, ніж продукт реакції, то їхня нестача компенсується в кислих та нейтральних розчинах молекулами води, а лужних – гідроксид йонами;
4. сумарна кількість та знак електричних зарядів у лівій і правій частині рівняння мають бути однаковими;
5. у разі підсумовування йонно-електронних рівнянь можна переносити члени рівняння з одного боку в інший, додавати однакові доданки в кожну частину рівняння. Наприклад, розглянемо реакцію взаємодії калій перманганату KMnO4 з калій йодидом КІ у кислому середовищі:

Запишемо окисно-відновне рівняння в скороченій йонно-молекулярній формі, відображаючи сильні електроліти у вигляді йонів, а слабкі у вигляді молекул. Ті йони, що не змінюють ступінь окиснення, не зазначають:
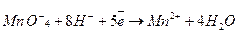
Напівреакція окиснення йодид-йона до йоду буде такою:

Щоб зрівняти кількість електронів, які беруть участь у напівреакціях окиснення та відновлення, потрібно напівреакцію окиснення помножити на 5, а напівреакцію відновлення на 2:

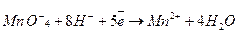 2
2
 5
5
Підсумувавши почленно ці напівреакції, одержимо
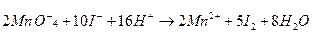
Якщо рівняння реакції складене правильно, то сумарний заряд усіх йонів у правій та лівій частинах рівняння повинен бути однаковим. Для написання молекулярного рівняння в лівій частині до кожного катіона та аніона підбирають відповідні аніони та катіони, а потім записують ці ж йони в такій же кількості у праву частину рівняння:
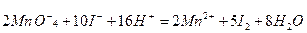
2К+ + 10K+ +8SO42-=2SO42-+ 12K++6SO42-
Після об`єднання цих йонів у молекули отримують молекулярне рівняння:
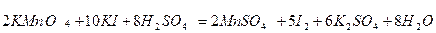
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1714; Нарушение авторских прав?; Мы поможем в написании вашей работы!