
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аппараты для биохимического анализа глюкозы и лактата
|
|
|
|
Среди всех биохимических тестов определение концентрации глюкозы в крови занимает особое место, поскольку определение гликемии является самым частым и, вероятно, одним из самых ответственных исследований, учитывая цену неправильного измерения.
Однако, интерпретируя результат лабораторного исследования гликемии, нужно учитывать высокую лабильность параметра, особенно у больных с нарушенной регуляцией этого гомеостатиче‑ского параметра при наличии сахарного диабета. Прием пищи, физические нагрузки, прием сахароснижающих препаратов, наконец, инъекции инсулина, существенно изменяя концентрацию глюкозы, обусловливают необходимость постоянного контроля уровня гликемии. В повседневной жизни пациенты с сахарным диабетом выполняют этот тест в домашних условиях, поскольку без этой информации им трудно скорректировать свою диету, дозу инсулина или пероральных сахароснижающих препаратов.
В современных клинико‑диагностических лабораториях наиболее широко применяются энзиматические методы, основанные на использовании фермента – глюкозооксидазы. Применение глюкозооксидазной реакции трансформирует задачу определения концентрации глюкозы в задачу определения концентрации перекиси водорода, которая, как показало время, значительно проще первой. Для этого широко используются фотометрическая или электрохимическая технологии. Фотометрический биохимический метод отличается высокой специфичностью и простотой выполнения. Суть метода состоит в том, что молекулы перекиси водорода под действием фермента пероксидазы расщепляются с образованием активной формы кислорода – отрицательного иона молекулы кислорода – который в свою очередь окисляет хромоген, что приводит к значительному изменению спектра поглощения хромогена. Глюкозооксидазный фотометрический метод признан сегодня одним из самых точных количественных методов определения глюкозы как в сыворотке (плазме), так и в цельной крови. При работе с цельной капиллярной кровью следует учитывать, что результат будет зависеть от гематокрита крови, влияя на точность определяемого параметра. Метод можно реализовать как с применением обычного фотометра, так и в биохимических автоанализаторах, прежде всего для выполнения достаточно больших объемов исследований с использованием сыворотки крови пациентов.
Наряду с методом фотометрирования по конечной точке получают распространение приборы, в которых реализован кинетический метод фотометрирования. Суть метода заключается в следующем: при определенном соотношении активностей глю‑козооксидазы и пероксидазы скорость образования окрашенного соединения будет некоторое время после внесения пробы в рабочий раствор пропорциональна концентрации глюкозы в пробе. Преимущество такого метода состоит в том, что результат не зависит от наличия в пробе поглощения от других соединений, поскольку это поглощение стабильно во времени.
Методы «сухой химии» сочетают в себе аналитическую точность количественного ферментативного метода со скоростью и простотой процедуры определения гликемии.
Измерение концентрации глюкозы из цельной крови с помощью приборов, работа которых основана на электрохимическом, в частности амперометрическом, принципе измерения, предполагает применение специальных ферментных датчиков. Перекись водорода является крайне нестабильным химическим соединением, и она служит источником заряженных частиц. Именно это и используется на ферментных датчиках мембранного типа или электрохимических элементах портативных глюкометров.
В измерительной ячейке стационарных приборов, сконструированной как проточная, находится измерительная камера, с одной стороны ограниченная ферментной мембраной. На мембрану специальным образом сорбирована глюкозооксидаза. С другой стороны мембраны к ней прижимается платиновый электрод. Проба цельной крови разводится в системном буферном растворе (эритроциты разрушаются), после чего подается в проточную ячейку. Глюкоза подвергается окислению под воздействием фермента глюкозооксидазы, находящейся на мембране. Образовавшаяся перекись водорода диффундирует через мембрану и окисляется далее в каталитической реакции под действием платины. Таким образом, диффузия перекиси водорода на поверхность платины приводит к появлению электрического тока, пропорционального числу молекул Н2О2, образующихся в единицу времени из молекул глюкозы. Электрический ток усиливается и измеряется аналого‑цифровым преобразователем прибора. Это измеренное значение пропорционально концентрации глюкозы в пробе.
Существует и другая модификация амперометрического метода измерения концентрации глюкозы в крови. Окисление глюкозы под действием фермента глюкозооксидазы сопровождается образованием восстановленной формы молекул ферроцианида калия, которые при контакте с электродом окисляются, отдавая один электрон. Таким образом, в результате окисления одной молекулы глюкозы на измерительный электрод попадает один электрон. Возникающий в результате химических реакций электрический ток пропорционален концентрации глюкозы. Электрический ток измеряется специальным электронным устройством и пере‑считывается в величину концентрации глюкозы. Данная система состоит из измерительного прибора и тест‑полоски. Последняя имеет микроячейку, содержащую комплекс реагентов и измерительные электроды. Реагенты содержатся в мембране тест‑полоски, которая напоминает губку с микроскопическими порами и выполняет несколько функций: она действует как резервуар, собирая необходимое количество крови, и как фильтр, блокирующий форменные элементы (эритроциты, лейкоциты и др.). При попадании крови в ячейку возникает электрический контакт и прибор начинает измерение.
Для того чтобы результат измерения получался в виде концентрации глюкозы, необходимо знать связь между величиной электрического тока и концентрацией глюкозы. Эта связь зависит от конструкции измерительной ячейки, а также от концентрации реагентов и активности фермента, содержащихся в ячейке. В практике клинической лабораторной диагностики приняты два способа выражения концентрации глюкозы в крови: содержание глюкозы в единице объема цельной крови и содержание глюкозы в единице объема сыворотки (плазмы) крови. Эти две величины различаются примерно на 12 %, и степень отличия для каждой пробы крови зависит от величины гематокрита. Поскольку сегодня в большинстве биохимических лабораторий концентрация глюкозы определяется в сыворотке крови, то и при определении концентрации глюкозы с применением портативных приборов желательно, чтобы результат измерения выражался в этих же величинах. Это упрощает сопоставление результатов анализов, сделанных в лаборатории и с помощью портативных глюкометров.
Аппараты для иммуноферментного анализа (ИФА)
Любое вещество, обладающее свойствами антигена, полноценного или неполноценного (гаптена), можно количественно определить с применением иммуноферментного анализа (ИФА). Для проведения ИФА необходимо иметь очищенный антиген, специфическое для этого антигена антитело, фермент в качестве метки для антигена или антитела и средство (устройство) для регистрации активности фермента.
Реакцию ИФА можно проводить двояко. В первом случае из антигена, находящегося в тестируемом образце, и меченого антитела, добавленного в концентрации, превышающей концентрацию антигена, образуется комплекс антиген‑меченое антитело. Количественно проанализировать такую реакцию можно по образованию комплекса антиген‑меченое антитело, определяемого с помощью ферментной метки, или по меченому антителу, оставшемуся в несвязанном состоянии. Это неконкурентный вариант ИФА.
Во втором варианте лимитирующим субстратом является антитело. Меченый антиген при добавлении в анализируемый образец в известной концентрации связывается с антителом, образуя комплекс меченый антиген‑антитело. В этой реакции меченый антиген будет конкурировать с немеченым антигеном, содержащимся в образце. Концентрация меченый антиген‑антитело будет обратно пропорциональна концентрации антигена. Таким образом по заранее известной концентрации меченого антигена можно определить неизвестную концентрацию антигена. Это конкурентный вариант ИФА. В обоих вариантах ИФА надо решить важную задачу – отделить связанную фракцию меченого реагента от несвя‑завшегося, свободного реагента, чтобы определить долю специфического связывания.
Наборы иммунохимических реагентов для определения антигенов называются диагностикумами. Для их создания необходимо решить задачи получения антигена, антитела, комплекса антигена или антитела с ферментом, наладить регистрацию иммунохимиче‑ской реакции по активности фермента, использованного в качестве метки. Кроме ферментов, в качестве меток для антигенов используют радиоактивные и флуоресцирующие соединения, такие реакции соответственно называются радиоиммунным и флуорес‑центноиммунным анализом (РИА и ФИА). Предпочтением пользуется ИФА, поскольку он не требует сложной измерительной аппаратуры и применения радиоактивных соединений.
Иммунохимический анализ не ограничивается ИФА, РИА и ФИА, которые основаны на прямом взаимодействии антигена с антителом. Имеются другие методы обнаружения и количественного определения антигенов в зависимости от их физического состояния при взаимодействии с антителами. Если антиген расположен на поверхности клеток, то антитела вызовут слипание (агглютинацию) таких клеток. Этот принцип лежит в основе определения групп крови: склеивание эритроцитов при взаимодействии поверхностных антигенов с добавленными антителами – гемагглютинация. Антитела при добавлении в определенном соотношении к раствору макромолекулярных антигенов вызывают их преципитацию – образование крупных, визуально обнаруживаемых агрегатов из молекул антигена, связанных антителами. Во время проведения реакции преципитации в гелях возникают линии преципитации при образовании иммунных комплексов антиген‑антитело, по форме этих линий можно судить о числе и иммунологическом родстве антигенов. Для идентификации белков широко применяется методика иммуноблоттинга: сначала смесь белков разделяют с помощью электрофореза в геле, затем на гель накладывают нитроцеллюлозную мембрану и на нее электрофо‑ретически переносят (подвергают электроблоттингу) разделенные белки, которые идентифицируют посредством меченых антител. Меченые антитела широко используют в исследовании локализации компонентов клеток и тканей – это методы имму‑ноцито– и иммуногистохимии. Клетки, меченные флуоресцирующими антителами, можно отделить от немеченых клеток – метод проточной цитофлуориметрии. Хроматографические колонки с сорбентом, с которым ковалентно связан антиген (или антитело), используются в аффинной хроматографии – отделении соответствующего антитела (или антигена) из смесей в результате образования иммунных комплексов. Еще одно применение иммунохи‑мического анализа – иммуносенсоры: пьезокристалл, покрытый антигеном (антителом), в результате связывания антител (антигена) увеличивает свою массу и меняет частоту резонансных колебаний в переменном электрическом поле, что позволяет регистрировать изменение массы пьезоэлектрика порядка 10–12 г.
Таким образом, ИФА – это лишь один из способов определения антигенов, получивший широкое практическое распространение благодаря возможности количественных определений, высокой чувствительности и коммерческой доступности. В научно‑исследовательской работе эти возможности иммунохимических методов всегда используются вместе с ИФА и даже с применением одних и тех же реагентов.
Возможности увеличения чувствительности ИФА ограничиваются фоном анализируемого соединения (т. е. его наличием не только в анализируемом образце, но и в используемых реактивах и растворителях), субстратной специфичностью фермента и аффинностью антител. К ограничениям ИФА относится также наличие в тестируемых образцах кофакторов, ингибиторов и стимуляторов активности ферментов. Еще один недостаток – ИФА не позволяет различать нативные белки и их биологически неактивные фрагменты, сохранившие антигенные детерминанты. Помехой для ИФА может быть изменение каталитической активности фермента при его конъюгировании с антигеном. Ограничением ИФА является его применимость лишь к хорошо изученным системам, где есть очищенные антигены и высокоспецифические антитела.
Высокая чувствительность в сочетании с быстротой анализа (от нескольких минут до нескольких часов), возможностью одновременного тестирования большого количества образцов и отсутствием особой необходимости предварительных операций по очистке и концентрированию анализируемого соединения в образце придают ИФА неоспоримые преимущества перед другими аналитическими методами. Поэтому сегодня ИФА находит широкое применение не только в здравоохранении, но и в различных областях сельского хозяйства, промышленной биотехнологии, природоохранной деятельности и научно‑исследовательской работе.
Любое заболевание человека и животных можно быстро и точно диагностировать путем идентификации возбудителя, его отдельных антигенных компонентов, антител к этим компонентам или веществ, не свойственных здоровому организму и синтезируемых при его патологических состояниях (рак, сердечно‑сосудистые и эндокринные заболевания). Диспансеризация населения, эпидемиологические обследования, выявление отравлений, наличия наркотиков в крови, определение содержания лекарственных соединений в тканях, вирусных заболеваний растений, определение антибиотиков, витаминов и других биологически активных соединений при отборе активных штаммов‑продуцентов в промышленной биотехнологии, контроль за качеством медицинских препаратов из донорской крови на отсутствие вирусов‑возбудителей СПИДа и гепатита В – это лишь небольшой перечень практического применения ИФА. Современные фундаментальные исследования в биохимии, клеточной физиологии и иммунологии, микробиологии, вирусологии, онкологии трудно представить без ИФА. Реагенты для проведения ИФА сегодня стали коммерческими продуктами и могут быть приобретены по каталогам известных фирм.
Автоматизированные ИФА‑анализаторы представляют собой модульную систему и состоят из автоматического дозатора образцов, сканера штрих‑кода пробирок, промывочного блока, инкубатора, устройства для считывания оптической плотности частиц, блока для обработки результатов, представленного, как правило, персональным компьютером с соответствующим программным обеспечением.
Дозатор образцов используется для раскапывания образцов из пробирок на любые форматы исследуемых носителей – микропланшеты, пробирки, специальные картриджи, а также дозирования реактивов.
Образцы могут находиться в пробирках различных размеров и диаметров в зависимости от конструкции прибора. Многие ИФА‑анализаторы оснащены датчиком детекции уровня жидкости образцов и реактивов и наличия сгустков, учитывая это, они могут использовать первичные пробирки с осажденным (но не удаленным) сгустком и эритромассой.
Процесс дозирования образцов и реактивов строится обычно таким образом, что они дозируются за один проход в несколько планшетов (рабочий стол вмещает одновременно от 1 до 5 планшет и от 2 до 14 реактивов). Например, если образцы исследуются на ВИЧ, гепатиты В и С, то за один проход они дозируются во все три планшета. В сочетании с использованием до 12 наконечников такая технология обеспечивает скорость дозирования 96 образцов (вместе с чтением штрих‑кода) и реактивов на 4 планшета (ВИЧ, гепатит В и С, сифилис) в среднем за 15–20 мин.
Встроенный сканер штрих‑кода пробирок обеспечивает идентификацию образцов, что является основой последующей автоматизации обработки информации. Вместе со сканерами штрих‑кода микропланшетов и реактивов это обеспечивает:
1) автоматическую идентификацию образцов и реактивов, устраняет возможные ошибки регистрации и загрузки реактивов;
2) автоматизирует процесс последующей обработки информации и выдачи результатов по конкретному образцу;
3) позволяет контролировать и регистрировать процесс обработки каждого образца (и соответственно лунки планшета), обеспечивая надежность результатов.
Модуль промывки (вошер) оснащен многоканальной промывочной головкой с функцией детекции уровня жидкости в лунках при промывке, что обеспечивает дополнительный контроль за качеством промывки и предотвращает возникновение ложных результатов.
Качество промывки обеспечивает отсутствие кросс‑контаминации, а многократное применение наконечников позволяет резко снижать себестоимость исследования. При этом сохраняется возможность в особо критических приложениях использовать наконечники в качестве одноразовых.
Затем микропланшеты с дозированными образцами и реактивами переносятся в инкубатор. Инкубация планшетов осуществляется в ячейках инкубации с индивидуально контролируемой температурой, конструкция которых обеспечивает отсутствие испарения реакционной смеси во время инкубации.
Считывание результата выполняется с помощью многоканального фотометра в моно– или бихроматическом режимах. Фотометр оснащается несколькими светофильтрами, работающими в диапазоне длин волн 340–850 нм.
Полученные данные оптической плотности обрабатываются на ПК врача‑лаборанта с помощью программ в соответствии с методикой интерпретации результатов, изложенной в инструкции к используемым тест‑системам. Полученные после интерпретации данные сохраняются в базе данных ПК, распечатываются в требуемом формате отчетности (настраивается пользователем) и передаются в информационную сеть лаборатории.
Производительность, помимо конструктивных особенностей комплекса, определяется также используемыми тест‑системами и их сочетанием, конфигурацией комплекса, длительностью работы оборудования и потому является достаточно индивидуальным параметром.
Аппараты экстракорпорального оплодотворения (ЭКО)
Экстракорпоральное оплодотворение (ЭКО) – это оплодотворение вне организма с последующим переносом развивающейся оплодотворенной яйцеклетки (эмбриона) в полость матки. Основными показаниями к процедуре ЭКО являются:
1) нарушения функции маточных труб;
2) снижение качества спермы;
3) некоторые формы эндометриоза;
4) патология слизи цервикального канала;
5) труднообъяснимое бесплодие (возможно, связанное с тем, что эмбрион не может покинуть блестящую оболочку, имплантироваться и развиваться) после проведенного полного клинического исследования, включая гормональное, эндоскопическое, иммунологическое.
Помимо причины бесплодия, большую роль играют возраст женщины и длительность бесплодия. Эффективность лечения определяется различными факторами.
Процедуру ЭКО можно разделить на несколько этапов лечения: отбор пациенток по показаниям; контроль за созреванием фолликулов (трансвагинальная эхография, исследование 17‑эст‑радиолы крови) и стимуляция созревания яйцеклеток, забор яйцеклеток (пункция), собственно экстракорпоральное оплодотворение (предынкубация, оплодотворение in vitro, культивирование, криоконсервация), перенос эмбрионов в полость матки (эмбрио‑трансплантация), контроль развития беременности и лечение после переноса.
Необходимо отметить, что существуют условия проведения эмбриотрансплантации, к ним относятся:
1) сохраненная в полном объеме функциональная способность матки к имплантации и вынашиванию беременности;
2) отсутствие противопоказаний к беременности и родам (соматические, психические, генетические заболевания);
3) сохраненная способность яичников к адекватному ответу на стимуляцию овуляции – экзогенную и эндогенную;
4) отсутствие новообразований, воспалительных и анатомических изменений в органах малого таза. Эти условия должны быть соблюдены еще на этапе отбора пациенток.
Также при подборе больных следует обратить внимание на следующие факторы.
1. Возраст родителей. У женщин в возрасте 40 лет в 23 раза чаще рождаются дети с синдромом Дауна (Simpson, 1979).
2. Наличие доказанной способности к зачатию.
3. Наличие нарушений метаболизма, таких как сахарный диабет, аутоиммунный тиреоидит и дефицит антитрипсина, предрасполагающих к появлению анэуплоидии у плода.
4. Наличие анэуплоидии. Если один из родителей является анэуплоидом, то увеличивается риск рождения детей с хромосомными нарушениями.
Все супружеские пары, отобранные для лечения по методу ЭКО, должны понимать его суть, знать о возможном риске и дать продуманное согласие на лечение.
За 2 или 3 месяца до начала активного лечения по методу ЭКО следует произвести полное исследование спермы, включающее бактериологическое исследование и посев, одновременно с исследованием влагалищных и цервикальных мазков с целью исключения патологии, вызванной гонококками, микоплазмой, грибами, трихомонадами и другими возбудителями. Лечение инфекционных заболеваний половых органов предпринимается с целью предупреждения заражения культуры, в которой производится оплодотворение, и осложнений после переноса эмбриона. Помимо этого, рекомендуется сделать мазки по Папаниколау с целью исключения рака шейки матки и поражения половых органов вирусом герпеса.
Во время предовуляторной фазы исследовательского цикла берут кровь для приготовления эмбриокультуры и проведения серологических исследований на токсоплазмоз, краснуху, цитоме‑галовирусы и вирусы герпеса, гепатит В и сифилис. Также следует исследовать кровь на хромосомы для идентификации лиц с повышенным риском воспроизводства анэуплоидных гамет. Сыворотку крови следует исследовать на предмет выявления ан‑тиспермальных антител и антител на блестящей оболочке.
На этапе предварительного обследования необходимо измерить длину цервикального канала и полости матки с помощью маточного зонда, учитывая последующий перенос эмбриона катетером.
Хотя существует мнение, что при естественном цикле шансы на успех достаточно велики, большинство специалистов считают, что при «стимулированном» цикле частота наступления беременности выше. Хорошо известно, что с увеличением числа трансплантируемых эмбрионов возрастает вероятность имплантации. Но отмечено, что частота многоплодной беременности также возрастает с увеличением числа внесенных эмбрионов. Поэтому рекомендовано введение не более трех эмбрионов. В целях получения наибольшего количества яйцеклеток широко и успешно применяют методы гормональной стимуляции овуляции (см. табл. 5).
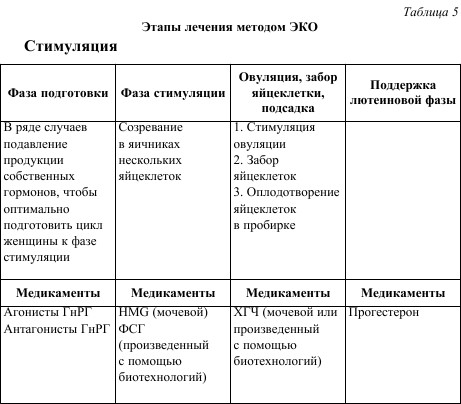
Главное отличие стимулированного цикла при ЭКО от естественного заключается в том, что под влиянием гормонов созревает не одна, а несколько яйцеклеток. Затем созревшие яйцеклетки извлекают из яичников, чтобы оплодотворить вне организма. Необходимость получения нескольких яйцеклеток обусловлена фактом, что не каждая яйцеклетка может быть оплодотворена, а также не все эмбрионы имеют одинаковые шансы на имплантацию. Наличие нескольких эмбрионов позволяет выбрать для переноса те из них, у которых вероятность имплантации наилучшая. Чтобы избежать осложнений и при этом получить максимальное количество зрелых яйцеклеток, гормональная терапия подбирается индивидуально.
Первый шаг лечения направлен на оптимальную подготовку организма к стимуляции гормонами. Регуляция менструального цикла проводится таким образом, чтобы временем овуляции и забора яйцеклеток можно было управлять. Это достигается с помощью медикаментов, которые подавляют продукцию собственных гормонов, стимулирующих работу яичников (ФСГ и ЛГ), – так называемая даунрегуляция. Медикаменты, используемые в фазе даунрегуляции, называются агонистами гонадотропин‑рилизинг гормона (агонисты ГнРГ) и воздействуют на ту часть мозга, которая ответственна за выброс гормонов ФСГ и ЛГ. Даунрегуля‑ция используется при проведении длинного протокола стимуляции и назначается с 19‑22‑го дня цикла. Препараты могут иметь различные названия и применяться в виде ежедневных инъекций, назального спрея или депо. Благодаря этой подготовке в дальнейшем улучшается возможность регулировать фазу стимуляции.
При проведении короткого протокола необходимы антагонисты ГнРГ, которые также применяются для подавления продукции собственных гормонов. Их оборот начинается только в фазе стимуляции, т. е. от начала менструации. Благодаря этому общее время лечения уменьшается и снижается риск появления симптомов гипоэстрогении.
Решение о выборе протокола принимает врач в зависимости от исходных данных пациентов.
Для стимуляции созревания яйцеклеток могут быть использованы различные препараты, которые соответствуют естественному гормональному циклу. Они различаются по технологии изготовления.
НМв (человеческий менопаузальный гонадотропин) получают из мочи женщин, находящихся в постменопаузе (климактерическом периоде). НМв содержит в одинаковой мере ФСГ и ЛГ.
Рекомбинантный ФСГ производят с помощью биологических технологий. Это чистый белок, полностью идентичный естественному гормону. Поэтому рекомбинантные препараты часто лучше переносятся пациентами.
В мочевых препаратах чистота и содержание ФСГ могут существенно колебаться, а также они чаще вызывают аллергию. Однако вероятность наступления беременности после стимуляции рекомбинантным ФСГ или мочевыми препаратами существенно не различается.
Стимуляция гонадотропинами (ФСГ) начинается, как правило, через 14 дней после начала даунрегуляции (длинный протокол) либо в течение первых трех дней цикла – короткий протокол (1‑й день цикла = 1‑й день менструации). Лечение гонадотропина‑ми длится в среднем 11–13 дней. В течение этого периода в одно и то же время суток осуществляются внутрикожные (или внутримышечные) инъекции определенного количества гормона. Если для подавления собственных гормонов используется антагонист ГнРГ, его введение начинается с 5‑7‑го дня стимуляции.
Во время стимуляции проводится ультразвуковое наблюдение. Этот мониторинг служит для контроля за количеством и размерами фолликулов, а также толщиной эндометрия. Таким образом можно выбрать оптимальный момент для начала овуляции и пункции фолликулов. Также благодаря наблюдению удается снизить риск гиперстимуляции.
Овуляция и забор яйцеклетки
Когда созревание яйцеклеток в фолликулах подходит к концу, необходимо отменить введение ФСГ. Теперь с помощью другого гормона – ХГЧ (хорионический гонадотропин человека) – яйцеклетки подготавливаются к овуляции. ХГЧ берет на себя роль ЛГ, которую последний выполняет в естественном цикле. ХГЧ получают из мочи беременных женщин, а в последнее время в чистом виде с помощью биотехнологий. Спустя около 36 ч после введения ХГЧ, незадолго до овуляции, происходит забор яйцеклеток из фолликулов.
Существует несколько методов забора яйцеклеток для оплодотворения. Ооциты могут быть получены при лапароскопии, мини‑лапаротомии или путем аспирации фолликулов под контролем УЗИ.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1440; Нарушение авторских прав?; Мы поможем в написании вашей работы!