
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение солей и их свойства
|
|
|
|
Получение амфотерных гидроксидов и определение их свойств
Опыт 8. Получение амфотерного гидроксида Аl(OH)3
Ход работы: В пробирку налейте 3 – 4 мл раствора соли алюминия прилейте такой же объём раствора гидроксида аммония NH4OH до образования белого аморфного осадка гидроксида алюминия (ΙΙΙ) Аl(OН)3. Дайте отстоятся выпавшему осадку.
Составьте молекулярные и ионные уравнения реакции.
Полученный осадок разделите на равные части в две пробирки. В одну прилейте раствор хлороводородной (соляной) кислоты, а во вторую – раствор гидроксида натрия NаOH или гидроксида калия КOH.
Наблюдайте за поведением осадка в пробирках. Запишите уравнения реакций в молекулярной и ионной форме. Сделайте вывод о свойствах гидроксида алюминия (ΙΙΙ) Аl(OН)3. Сделайте вывод о способах получения и свойствах амфотерных гидроксидах.
Опыт 9. Получение амфотерного гидроксида Fe(OН)3
Ход работы: В пробирку налейте 2 – 3 мл раствора соли железа (ΙΙΙ) FeCl3, Fe(NO3)3 или Fe2(SO4)3 и добавьте к нему равный объём раствора гидроксида аммония NH4OH. Наблюдайте образование бурого аморфного осадка гидроксида железа (ΙΙΙ) Fe(OН)3.
Составьте молекулярное и ионные уравнения реакции.
Полученный осадок разделите на равные части в две пробирки. В одну прилейте раствор хлороводородной (соляной) кислоты, а во вторую – раствор гидроксида натрия NаOH или гидроксида калия КOH.
Отметьте поведение осадка в пробирках. Запишите уравнения реакций в молекулярной и ионной форме. Сделайте вывод о свойствах гидроксида железа (ΙΙΙ) Fe(OН)3. Сделайте вывод о способах получения и свойствах амфотерных гидроксидов.
Опыт 10. Получение амфотерного гидроксида и разложение его при нагревании
Ход работы: Налейте в пробирку 2 – 3 мл раствора сульфата меди (ΙΙ) CuSO4 и добавьте такой же объем раствора гидроксида натрия NаOH или гидроксида калия КOH. Образуется голубой осадок гидроксида меди (ΙΙ) Cu(ОН)2, являющийся труднорастворимым в воде соединением.
Пробирку с осадком нагрейте на пламени спиртовки.
Наблюдайте образование черного осадка оксида меди (ΙΙ) CuО. Напишите уравнения реакций в молекулярной и ионной форме. Сделайте вывод о термической устойчивости амфотерных гидроксидов и труднорастворимых оснований.
Опыт 11. Получение и свойства средних солей
а) Взаимодействие металла с кислотой:
Ход работы: В пробирку опустите гранулу цинка, добавьте 2н. раствор Н2SO4.
Отметьте эффект реакции. Составьте молекулярное и ионные уравнения реакции. Сделайте вывод о способе получения соли.
б) Взаимодействие соли с металлом:
Ход работы: В пробирку прилейте 0,1н. раствор CuSO4 затем поместите в раствор гранулу цинка. Дайте постоять 5 минут.
Отметьте эффект реакции. Составьте молекулярное и ионные уравнения реакции. Сделайте вывод о способе получения солей и их свойствах.
в) Получение солей при взаимодействии основания и кислотного оксида
Ход работы: В пробирку налейте 5 мл раствора гидроксида кальция (известковой воды) Са(ОН)2 и пропустите через раствора оксид углерода (ΙV) (углекислый газ) СО2 из аппарата Киппа.
Наблюдайте помутнение раствора в результате образования взвешенных частиц средней соли угольной кислоты СаСО3. Продолжайте пропускать газ через раствор до тех пока, пока весь осадок не растворится в результате образования растворимой соли Са(НСО3)2.
Напишите молекулярные и ионные уравнения реакций. Сделайте вывод о растворимости кислой и средней солей угольной кислоты, их получении и свойствах.
г) Получение труднорастворимой соли при взаимодействии кислоты с растворимой солью
Ход работы: В пробирку налейте 2 мл раствора хлорида бария ВаCl2 и прилейте такой же объем серной кислоты Н2SO4. При добавлении к раствору серной кислоты выпадает белый осадок труднорастворимой соли.
Наблюдайте образование осадка. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способах получения, свойствах солей.
д) Взаимодействие соли со щелочью
Ход работы:
К раствору хлорида железа (III) добавьте раствор щелочи.
Наблюдайте образование осадка. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способах получения, свойствах солей.
е) Взаимодействие труднорастворимой соли с кислотой
Ход работы: Положите в пробирку кусочек карбоната кальция (мела или мрамора) СаСО3 и прилейте 2 мл раствора хлороводородной кислоты.
Наблюдайте выделение газа. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о свойствах соли.
ж) Разложение соли при нагревании
Ход работы: Гидроксокарбонат меди (ΙΙ) (CuOH)2CO3 разлагается при нагревании на три вещества: оксид углерода (ΙV), оксид меди (ΙΙ) и воду:
(CuOH)2CO3 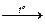 CO2↑ + CuO + H2O.
CO2↑ + CuO + H2O.
Cоберите прибор, как указано на рисунке 1. Насыпьте в пробирку до 1/4 её объёма порошок гидроксокарбоната меди (ΙΙ). Закройте пробку с газоотводной трубкой и укрепите её в зажиме штатива так, чтобы пробирка была слегка наклонена в сторону пробки. Газоотводную трубку опустите в пустую склянку (химический стакан или коническую колбу). Нагрейте пробирку с основной солью в пламени спиртовки, начиная нагревать от горловины пробирки до дна её. Нагревайте до тех пор, пока всё содержимое пробирки не превратится в черный порошок. Наблюдайте конденсацию воды на холодных частях пробирки. Выньте газоотводную трубку из склянки и проверьте собранный в колбе газ при помощи горящей лучинки.
Сделайте вывод о свойствах основной соли.
и) Взаимодействие соли с другой солью
Ход работы: В пробирку налейте 2 мл раствора нитрата свинца Pb(NO3)2 и прилейте такое же количество раствора иодида калия KI.
Отметьте эффект реакции. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способе получения и свойствах средней соли.

Рис. 1 − Разложение малахита
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1118; Нарушение авторских прав?; Мы поможем в написании вашей работы!