
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 11 страница
|
|
|
|
а) Пробирканың 1/3 бөлігіне дейін кальций гидроксидін құйыңыз да оған көміртек оксидін (ІV) Кипп аппаратынан ақ тұнба - СаСО3 түзілгенше өткізіңіз, содан кейін, осы түскен тұнба қайта ерігенше көмір диоксидін өткізіңіз.
б) Кальций гидрокарбонаты ерітіндісін (тәжірибе 5а) үш пробиркаға тең бөліңіз. Бірінші пробиркадағы ерітіндіні қайнағанша қыздырыңыз, жайымен тұнба түсе бастағанын байқаңыз.
2-ші пробиркадағы ерітіндіге кальций гидроксидін қосыңыз, ал үшінші пробиркадағы ерітіндіге натрий карбонатын қосыңыз. Пробиркалардың үшеуінде де жәйлап тұнба түзілгенін байқаңыз.
Жүретін реакциялардың теңдеулерін жазыңыз.
6-тәжірибе: Мыс пен кобальтың негізді тұздарын алу.
а) Екі пробиркаға 2-3 мл мыс сульфатының ерітіндісін құйыңыз.
1-ші пробиркаға көк тұнба түзілгенше 2-3 мл натрий гидроксидін (СNaOH=2Н) қосыңыз. 2-ші пробиркаға натрий гидроксидін (СNaOH=0,1Н) тамшылатып аспан түсті көк тұнба түзілгенше қосыңыз. (әрбір тамшыдан соң араластыру керек). Екі пробиркадағы тұнбаны абайлап қайнағанша қыздыру керек.
Неге бірінші пробиркадағы тұнба қараяды, ал екіншісіндегі тұнба өзгермейді, соған түсінік беріңіз және тиісті реакциялардың теңдеулерін жазыңыз.
б) Кобальт хлоридінің (ІІ) ерітіндісіне тамшылап натрий гидроксидін (СNaOH=0,1Н) тұнба түзілгенше қосыңыз (әрбір тамшыдан соң араластырып отыру керек).
Тұнбаның түсі қандай? Осы тұнбаны ерітіндісімен бірге екі пробиркаға тең бөліңіз.
Біреуіне натрий гидроксидінің тең көлемін құйып содан кейін қыздырыңыз. Басқасына тұз қышқыл ерітіндісін тұнба толық ерігенше қосыңыз. Тиісті реакциялардың теңдеулерін жазыңыз.
7-тәжірибе: Амфотерлік гидроксидтердің қасиеттері.
а) 2-3 мл алюминий тұзының ерітіндісіне тамшылатып және араластыру арқылы калий гидроксидін (СКОН=0,1Н) тұнба түзілгенше қосыңыздар.
Тұнбаны ерітіндімен бірге екі пробиркаға бөліңіз. Біреуіне артығымен калий гидроксидін, ал екіншісіне тұнба толығымен ерігінше қышқыл қосыңыз. Екі пробиркадағы да тұнба еріп кетуі қажет.
Неге екі пробиркадағы да тұнба еріп кетеді? Гидроксидтің амфотерлік қасиетіне анықтама беріңіз.
б) Осы сияқты бақылауларды мырыш, хром тұздарын алып орындап көрсетіңіз.
1.6Бақылау сұрағы:
Орта тұздар алудың 10 тәсілін жазыңыз.
1.7 Жұмысты өндеу:
Лабораториялық дәптерге тәжірибелердің атын, реакциялардың молекулалық, иондық теңдеулерін және алынған заттардың ерекше қасиеттерін (тұнбаның түсі, газдың иісі т.б.) жазыңыз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс №2
Мырыштың эквиваленттік массасын анықтау
2.1 Жұмыстың мақсаты.
Бұл жұмыста мырыштың эквиваленттік массасы қышқылдан сутекті ығыстыру арқылы анықталады.
2.2 Жұмыстың мазмұны:
а) эвдиометрдің газ шығармайтындығын тексеру;
б) тәжирібе жүргізу;
в) бөлініп шыққан сутектің көлемін өлшеу және қалыпты жағдайға келтіру;
г) мырыштың эквиваленттік массасын және салыстырмалы қатені есептеу.
2.3 Қажетті қондырғырлар мен реактивтер:
1. эвдиометр;
2. өлшенген мырыш грануласы;
3. тұз қышқылының ерітіндісі;
4. дистилленген су;
5. барометр;
6. термометр.
2.4. Жұмыстың орындалуы және теориялық негіздері.
1. «Химиялық эквивалент» деп нені айтады?
Металдың эквиваленті деп оның қалыпты жағдайда, яғни қысым 101,325 кПа (760 мм), температура 273 К (00 С) болғанда 11,2 л немесе 1 грамм сутекті қышқылдан ығыстырып шығаратын массасын айтады.
2. Эквиваленттер заңының аныктамасы:
Элементтер бір-бірімен өздерінің эквиваленттік массаларына пропорционал массалық мөлшерлерде әрекеттеседі:


3. Газ күйінің теңдеуін жазыңыз:

осы теңдеуден сутектің қалыпты күйдегі көлемін анықтауға болады:
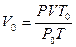
Металдың эквиваленттік массасын анықтауға арналған аспап (эвдиометр).
1. көлемі 50 мл бюретка;
2. екі тармақты пробирка (Оствальдтің пробиркасы);
3. теңестіретін сауыт ретінде қызмет атқаратын ашық түтік;
4. штатив.
Жұмысты орындаудың алдында аспаптың жұмысқа дайындығын (газ шығармайтындығын) тексеру керек. Ол ұшін: 1. теңестіретін түтіктен воронка арқылы бюретканы нольдік бөліміне дейін сумен толтырып, аспаптағы ауаны ығыстыру қажет.
2. Содан кейін бюретканы штативке бекіту керек. Егер аспап жұмыс істеуге дайын болса, алғашқы кезде бюреткадағы су аздап төмен түседі де, одан кейін тұрақты деңгейде қалып қояды. Егер аспап дұрыс болмаса бюреткадағы су үздіксіз төмен түсе береді. Бұл жағдайда оқытушы мен лаборанттың көмегімен аспапты түзеу керек.
3. Мырыш грануласын Оствальд пробиркасының тармақтың біреуіне өлшеп салыңыз, ал екінші тармаққа тұз қышқылының (1:1) ертіндісін құйыңыз.
4. Оствальд пробиркасын төңкеріңіз, сонда қышқыл мырыш бар тармақтан төгіледі, екеуінің арасында реакция басталады.
5. Реакция нәтижесінде бөлініп шыққан сутек бюреткадағы суды ығыстырады. Теңестіретін түтікті реакция барысында төмендету қажет. Сонымен қатар түтік пен бюреткадағы су бір деңгейде болу керек, яғни аспаптағы газ қысымы атмосфералық қысымға жақын болуы қажет.
6. Мырыш толық еріп кеткеннен кейін, бюретка арқылы бөлініп шыққан сутектің көлемін өлшеу керек.
2.5 Алынған нәтижелерді өндеу мен есептеу
1. Металдың массасы (m) - г
2. Бөлінген сутектің көлемі (V) - мл
3. Атмосфералық қысым (Р) - кПа
p0 = 101325 Па = 760 мм с. б.
4. Тәжірибе температурасы (t0 C)
5. Абсолюттік температура (Т) - 273 + t0 C
6. Тәжірибе температурасындағы су буының қысымы (W) - мм.
7. Аспап ішіндегі сутектің қысымы (P-W) – кПа
8. Қалыпты жағдайға келтірілген сутектің көлемі V0 (H2).
Металл ығыстырған сутектің көлемі: сутектің парциалдық қысымы:
РН2 = P - W.
9. Металдың эквиваленттік массасын табудың бірінші жолы.
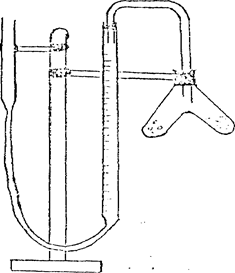
Металл ығыстырған сутектің көлемін Менделеев - Клапейрон теңдеуі бойынша қалыпты жағдайға келтіреді:
 немесе
немесе  .
.
Мұндағы Т = t  273 - абсолюттік температура, Р0 = 760 мм. с. б. немесе 101,325 кПа; Т0 = 273 К. Vc(H0) - ығысқан сутектің қалыпты жағдайдағы көлемі.
273 - абсолюттік температура, Р0 = 760 мм. с. б. немесе 101,325 кПа; Т0 = 273 К. Vc(H0) - ығысқан сутектің қалыпты жағдайдағы көлемі.
Қалыпты жағдайда сутек молекулалары молінің 2 г массасы 22,4 л көлем алса, атомдар молінің массасы 1г - 11,2 л немесе 11200 мл көлем алады.
Металдың эквиваленттік массасын Э(Ме) мына формула бойынша табамыз:


Металдың эквиваленттік массасын табудың екінші жолы. Бұл әдіс бойынша Менделеев-Клапейрон теңдеуі арқылы РV=m/MRT сутектің массасын тауып, оны эквиваленттер заңының теңдеуіне  қою арқылы металдың эквиваленттік массасын табады.
қою арқылы металдың эквиваленттік массасын табады.
10. Тәжірибенің салыстырмалы қатесін табу:


Бақылау сұрағы:
1. Мыс қосылыстарында бір және екі валентті болады. Мыстың атомдық массасы мен валенттіліктерні пайдаланып бір және екі валенті мыстың эквиваленттерін анықтаңыздар.
2. 1г металл 1,78 г күкіртпен қосылады. Күкірттің эквиваленті 16г/моль екенін еске алып металдың эквивалентін есептеп шығарыңыз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 3
Химиялық реакцияның жылдамдығы
3.1 Жұмыстың мақсаты
Химиялық реакцияның заттардың концентрациясына және температураға тәуелді екенін зерттеу.
3.2 Жұмыстың мазмуны
а) Тиокүкірт қышқылыңың ыдырау жылдамдығының тиосульфаттың концентрациясына байланысты өзгеруі;
в) Тиокүкірт қышқылыңың ыдырау жылдамдығының температураға байланысты өзгеруі.
3.3 Жұмыстың теориялық негіздері және орындау тәртібі
Химиялық процестің жылдамдығы деп уақыт бірлігіндегі заттың концентрациясының өзгеруін айтады:
V = (C2  - C1) / (i2 – i1) = ± DC/ Di
- C1) / (i2 – i1) = ± DC/ Di
1. «Әрекеттесуші массалар»заңы бойынша: химиялық реацияның жылдамдығы реакцияға түсетін заттардың концентрацияларының көбейтіндісіне тура пропроционал болады:
V = K×CnA×CmB
2. Вант-Гофф ережесі бойынша: химиялық реакцияның температурасын әрбір 100 -қа көбейткен сайын, процестің жылдамдығы 2-4 есе артады
V2/V1 = g (t2 – t1)/10
мұнда: g- температуралық коэффициент.
Бұл жұмыста тиокүкірт қышқылының (H2S2O3) өздігімен ыдырау процесінің жылдамдығы зерттеледі.
Тиосульфаттың ертіндісіне күкірт қышқылын қосканда келесі реакциялар орын алады:
1) Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4 реакцияның тез жүретін сатысы;
2) H2S2O3 = H2SO3 + S, реакцияның баяу жүретін сатысы;
3) H2SO3 = SO2 + H2O, реакцияның тез жүретін сатысы.
Реакцияның жылдамдығы баяу жүретін сатысының жылдамдығымен аңықталады. Бұл процесте ең баяу жүретін сатысы - екінші саты. Сондықтан осы саты бойынша бөлініп шығатын коллоидты күкірттің уақытын аңықтау арқылы реакцияның жылдамдылығы есептелінеді.
3.4 Қажетті қондырғылар мен реактивтер:
1. секундомер;
2. термометр;
3. ертінділер: С(Na2S2O3) = 0,0025 моль/л,
C(H2SO4) = 0,0025моль/л
1-ші тәжірибе. Реакция жылдамдығының заттар концентрациясыларына тәуелділігі.
Үш пробирканың біреуіне 1 мл натрий тиосульфаты ертіндісі мен 2 мл су, екіншісіне 2 мл натрий тиосульфаты ертіндісі мен 1 мл су, үшінші пробиркаға 3 мл натрий тиосульфаты ертіндісін құяды. Үшеуіне де 1мл ден күкірт қышқылы ертіндісін қосады, пробирканы шайқай отырып әрбір пробиркада ертіндінің лайлануы қанша секундта байқалатынын секундомер арқылы анықтайды. Яғни тиосульфат ертіндісіне күкірт қышқылын қосқанда коллоидты күкірт түзілуне қанша уақыт қажет екенін есептейді.
Алынған тәжірибе нәтижелерін кесте түрінде жазады
| № | Na2S2O3, мл | H2SO4, мл | H2O, мл | Жалпы көлем | Уақыт, с | 1/i, с-1 |
Осы мәліметтерді пайдалана отырып абсцисс осіне натрий тиосульфатының концентрацияларын жазып, ал ординат осіне реакция жылдамдығын 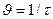 жазып, химиялық реакция жылдамдығының концентрацияға тәуелділігін графиктік түрде көрсетіңіз.
жазып, химиялық реакция жылдамдығының концентрацияға тәуелділігін графиктік түрде көрсетіңіз.
Әрекеттесуші заттар концентрацияларының реакция жылдамдығына әсері туралы қорытынды жаса және бұл мәліметтер химиялық кинетика заңына сәйкес келе ме?
2-тәжірибе: Реакция жылдамдығының температураға тәуелділігі
Үш пробиркаға концентрациялары бұрынғы тәжірибеде көрсетілгендей 3 мл - ден тиосульфат ертіндісін, ал басқа үш пробиркаға 3 мл- ден күкірт қышқылы ертіндісін құяды және бұларды әрқайсысы тиосульфат ертіндісімен күкірт қышқылынан тұратын үш жұпқа бөледі.
Бірінші жұптағы тиосульфат ертіндісі мен күкірт қышқылы құйылған пробиркаларды және термометрді су құйылған стаканға салады да температуралары теңескенше 4-5 минут күтеді де термометрдің көрсеткен температурасын жазып алады. Енді тиосульфат ертіндісі құйылған пробиркаға күкірт қышқылын құяды да бірнеше рет шайқап секундомер арқылы ертінділер қосылған (құйылған) уақытпен ең алғашқы күкірт пайда болған уақытты анықтап алады.
Екінші жұп пробиркаларды су құйылған стаканға салып бірінші (алғашқы) жұп пробиркалардың температурасымен салыстырғанда 100-қа жоғары қыздырады да, тиосульфат ертіндісімен күкірт қышқылын бір-біріне құйып секундомер арқылы күкірт пайда болған 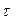 уақытты анықтап алады. Үшінші жұп пробиркаларды да су құйылған стаканға салып, екінші тәжірибемен (екінші жұп пробиркаларымен) салыстырғанда температурасын тағы да 100- қа арттырып тиосульфатпен күкірт қышқылы ертінділерін, бір-біріне қосып күкірт пайда болған уақытты анықтайды.
уақытты анықтап алады. Үшінші жұп пробиркаларды да су құйылған стаканға салып, екінші тәжірибемен (екінші жұп пробиркаларымен) салыстырғанда температурасын тағы да 100- қа арттырып тиосульфатпен күкірт қышқылы ертінділерін, бір-біріне қосып күкірт пайда болған уақытты анықтайды.
Алынған тәжірибе мәліметтерін мынандай түрде жазады:
| № | Na2S2O3, мл | H2SO4, мл | Tемпература, oC | уақыт,
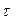 , с , с
| Реакция жылдам-дығы
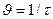
|
| t0 C | |||||
t0 C  10 10
| |||||
t0 C  20 20
|
Реакция жылдамдығының температураға тәуелділігін көрсететін график құру керек. Ол үшін абцисс осіне белгілі бір масштабпен тәжірибелердің температураларын, ал ординат осіне реакция жылдамдығын  жазады.
жазады.
Химиялық реакция жылдамдығының әрекеттесетін заттар температураларына байланыстылығы туралы қорытынды жасаңыз.
Бақылау сұрағы:
Тәжірибе мәліметтерін пайдаланып реакцияның температуралық коэффициентін есептеп шығарыңыз. Бұл тапқан температуралық коэффициенттер Вант-Гофф ережесіне сәйкес келе ме?
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс №4
Темір хлориді (ІІІ) мен калий роданидінің арасындағы кайтымды реакцияның тепе-теңдігінің ығысуы.
4.1 Жұмыстың мақсаты
Химиялық тепе-теңдіктің ығысуы мен заттардың концентрацияларының арасындағы тәуілділікті зерттеу.
4.2 Жұмыстың теориялық негіздері мен орындау тәртібі
Аяғына дейін жүрмейтін химиялық реакцияларды «қайтымды реакциялар» деп айтады. Қайтымды реакциялар үшін химиялық теңдеуде теңістік таңбаның орнына қайтымдылықтың таңбасы қойылады:  .
.
Қайтымды реакциялар жүргенде тепе-теңдік орнығады. «Химиялық тепе-теңдік» деп тікелей реакцияның жылдамдығы  кері реакцияның жылдамдығына
кері реакцияның жылдамдығына 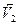 тең болған жағдайды айтады (
тең болған жағдайды айтады ( =
= 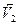 ). Орныққан тепе-теңдік жағдайды теңдіктің оң және сол жағындағы заттардың концентрацияларын өзгерту арқылы ығыстыруға болады. Тепе-теңдіктің ығысуы Ле-Шателье ережесі бойынша жүреді.
). Орныққан тепе-теңдік жағдайды теңдіктің оң және сол жағындағы заттардың концентрацияларын өзгерту арқылы ығыстыруға болады. Тепе-теңдіктің ығысуы Ле-Шателье ережесі бойынша жүреді.
4.3 Қажетті қондырғылар мен реактивтер:
а) пробиркалар;
б) ертінділер: С(FeCІ3) = 0,0025 моль/л, С (KSCN) = 0,0025 моль/л;
в) қаныққан темір хлоридінің, калий роданидінің және калий хлоридінің ертінділері.
Тәжірибені өткізу.
1) Екі пробиркаға 5 мл-ден темір хлоридінің С(FeCl3) = 0,0025 моль/л және калий роданидінің С (KSCN) = 0,0025 моль/л ертінділерін құйып алыңыз.
2) Екі ертіндіні бір-біріне қосыңыз.
3) Алынған ертіндіні шынылы таяқшамен араластырыңыз, ертіндінің бояуын байқаңыз және төрт пробиркаға бөліңіз.
4) Бірінші пробиркадағы ертіндіні эталон ретінде сақтаңыз.
5) Екінші пробирқаға 1 мл қаныққан FeCІ3 ертіндісін қосыңыз.
6) Үшінші пробирқаға 1мл қаныққан KSCN ертіндісін қосыңыз.
7) Төртінші пробиркаға калий хлоридінің бірнеше кристаллигін салыңыз. Алынған ертінділердің бояуын эталонмен салыстырыңыз.
Тәжірибенің нәтижесін өңдеу.
Бақылау сұрағы:
1. Кайтымды реакцияның және тепе-теңдік константаның теңдеулерін жазыңыз.
2. Ертіндінің түсі қалай өзгереді?
3. 2, 3, 4 пробиркалардағы химиялық тепе-теңдік қай бағытта ығысады?
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 5.
Электролиттік диссоциация және иондық процестер.
5.1 Жұмыстың мақсаты
Әлсіз және күшті электролиттердің қасиетін зерттеп, олардың алу жолдарымен танысу және иондық теңдікті жазып үйрену.
5.2 Жұмыстың мазмұны
1. Ертінділердің электр өткізгіштігі.
2. Иондық процестер.
3. Қышқыл мен негіздердің химиялық активтіліктерін салыстыру.
5.3 Теориялық бөлім және жұмыстың барысы
Электролиттер - сулы ертіндіде және балқымаларда ионға диссоциаланатын заттар. Әлсіз электролиттер қайтымды тепе-теңдік түзеп өте аз иондарға диссоциацияланады. Диссоциациялану константасы (Кд) әлсіз қышқылдың, негіздің, ал ерігіштік көбейтіндісі (ЕК) нашар еритін тұздар мен гидроксидтердің сипаттамалары болып келеді. (Кд және ЕК-нің мәндері кестелерде берілген).
5.4 Қолданылатын реактивтер мен аспаптар.
1. Стакандар (көлемі 100 см3) - 7, көмір стержендері мен шам, электрошнур мен вилка.
2. Қант, сірке қышқылы, тұз қышқылы, аммоний гидроксиді, натрий гидроксиді, калий нитраты ертінділері.
3. Темір (ІІІ), мыс, аммоний тұздарының, натрий силикатының, аммоний молибдатының, натрий карбонатының, натрий ацетатының, калий иодидінің, аммоний сульфидінің, кальций карбонатының ерітінділері.
І-тәжірибе. Ертінділердің электрөткізгіштігі
Ертінділердің электрөткізгіштігін өлшеу үшін қышқылдардың, тұздардың және гидроксидтердің сулы ертінділері алынады.
Көлемі 100 мл 7- стаканға 20-30 мл ден кестеде көрсетілген ертінділерді құйып алады да көмір электродтар батырылады, электр тоққа қосылады, электр шамының жану күшіне қарап электролиттің күші туралы қорытынды жасалады.
| № | Электролит | Электр шамының жану күші |
| Қанттың ертіндісі | ||
| Дистилленген су | ||
| Сірке қышқылы | ||
| Тұз қышқылы | ||
| Аммоний гидроксиді | ||
| Натрий гидроксиді | ||
| Калий нитраты |
Неге ертінділердің концентрациялары бірдей болып алынған?
Зерттелген ертінділердің электрөткізгіштігі неге әртүрлі? Осы электролиттердің диссоциациялану теңдеулерін жазып, әлсіз электролиттердің диссоциациялану константасын Кд анықтаңыз.
2 тәжірибе. Иондық процестер:
а) нашар еритін негіздерді алу
Бір пробиркаға 2-3 мл темір (Ш) хлоридінің ертіндісін құйыңыз және 2-3 мл натрий гидроксидінің ертіндісін қосыңыз.
б) әлсіз негізді алу
Бір пробиркаға 2-3 мл аммоний хлоридін құйыңыз және 2-3 мл (Скон = 2 моль/л) калий гидроксидін қосыңыз. Иісінен қандай газ бөлінетінін байқаңыз.
в) нашар еритін қышқылды алу
Бір пробиркаға 2-3 мл натрий силикатының, екінші пробиркаға 2-3мл аммоний молибдатының ертіндісін құйыңыз. Екі пробиркаға қышқылдардың тұнбалары түзілгенше тұз қышқылының ертіндісін қосыңыз.
г) әлсіз қышқылдарды алу. Бір пробиркаға 2-3 мл натрий карбонатының ертіндісін, екінші пробиркаға натрий ацетаты ертіндісін құйыңыз. Екі пробиркаға да тұз қышқылы ертіндісін қосыңыз. Бірінші пробиркада қандай газ бөлінеді? Иісінен екінші пробиркада қандай қышқыл түзілгенін байқауға болады?
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1400; Нарушение авторских прав?; Мы поможем в написании вашей работы!