
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОПЫТ 3. Определение концентрации кислоты в приготовленном растворе
|
|
|
|
ОПЫТ 2. Приготовление раствора
Выполнение:
1) Расчет объёма исходного раствора кислоты:
а) Исходя из величин объёма раствора и молярной концентрации эквивалентов кислоты, указанных в задании, рассчитайте массу кислоты, которая будет содержаться в приготовленном растворе.
б) Исходя из массы кислоты и массовой доли ее в исходном растворе, рассчитайте массу этого раствора.
в) Исходя из массы исходного раствора и его плотности, рассчитайте объём данного раствора.
2) Приготовление раствора:
а) Мерную колбу указанного объёма наполните примерно наполовину дистиллированной водой.
б) Отмерьте рассчитанный объём исходного раствора кислоты узким мерным цилиндром.
в) Осторожно перелейте через воронку отмеренный объём раствора в мерную колбу с водой и перемешайте ее содержимое круговыми движениями. Аккуратно долейте в колбу дистиллированную воду, доведя уровень нижнего мениска жидкости до метки на горлышке колбы. При этом последние порции воды добавляйте по каплям. Закройте колбу и, удерживая пробку, тщательно перемешайте раствор, несколько раз перевернув колбу вверх дном.
Выполнение (состоит из 3-х частей):
1) П о д г о т о в к а б ю р е т к и к р а б о т е
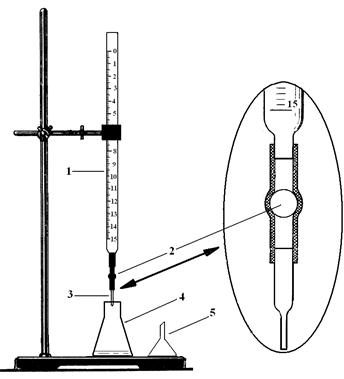 |
а) Соберите прибор для титрования (рис. 3). Бюретку закрепите строго вертикально над основанием штатива. При этом шкала бюретки должна быть обращена к вам. Высоту бюретки отрегулируйте так, чтобы ее капилляр был на 0,5 – 1 cм ниже горлышка колбы для титрования, стоящей на основании штатива.
 |
б) Заполните бюретку приготовленным раствором кислоты примерно до нулевого деления, осторожно приливая в нее раствор из мерной колбы через воронку. При этом воронку следует удерживать слегка приподнятой, чтобы вытесняемый раствором воздух свободно выходил из бюретки.
в) Промойте бюретку. Для этого слейте из нее раствор кислоты через капилляр в стакан. Промытую бюретку снова заполните раствором кислоты примерно до нулевого деления и удалите из капилляра бюретки пузырьки воздуха. Для этого капилляр поднимите вверх и сливайте раствор из бюретки в стакан до тех пор, пока он не вытеснит из капилляра все пузырьки воздуха (рис. 4).
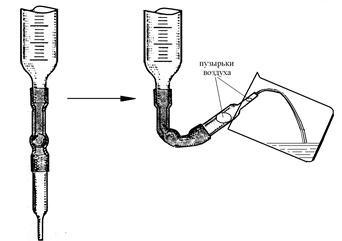
 |
г) Установите уровень жидкости в бюретке на нулевом делении. Для этого долейте в бюретку из мерной колбы столько раствора, чтобы его уровень был выше отметки «0» примерно на 1 см. Затем, убрав с бюретки воронку (!!!), осторожно, по каплям (!!!) сливайте раствор в стакан, пока нижний мениск жидкости в бюретке не совпадет с делением «0».
2. Т и т р о в а н и е
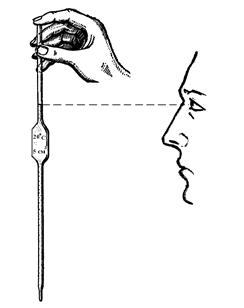 а) В колбу для титрования отмерьте с помощью пипетки строго определенный объём (аликвóту) раствора щёлочи (5 или 10 см3) с известной эквивалентной концентрацией (0,1 моль/дм3). Для этого, держа пипетку большим и средним пальцами, опустите её на максимальную глубину в раствор щёлочи. Осторожно затягивая воздух из пипетки резиновой грушей, наберите в пипетку столько раствора, чтобы его уровень оказался выше метки на 1 – 1,5 см. Затем быстро, не извлекая пипетку из раствора, закройте её указательным пальцем. Колбу с раствором и пипеткой поднимите до такой высоты, чтобы метка оказалась на уровне ваших глаз (рис. 5).
а) В колбу для титрования отмерьте с помощью пипетки строго определенный объём (аликвóту) раствора щёлочи (5 или 10 см3) с известной эквивалентной концентрацией (0,1 моль/дм3). Для этого, держа пипетку большим и средним пальцами, опустите её на максимальную глубину в раствор щёлочи. Осторожно затягивая воздух из пипетки резиновой грушей, наберите в пипетку столько раствора, чтобы его уровень оказался выше метки на 1 – 1,5 см. Затем быстро, не извлекая пипетку из раствора, закройте её указательным пальцем. Колбу с раствором и пипеткой поднимите до такой высоты, чтобы метка оказалась на уровне ваших глаз (рис. 5).
 б) Держа закрытую пипетку строго вертикально, приподнимите ее так, чтобы капилляр оказался над поверхностью раствора и касался внутренней стенки колбы. Осторожно сдвигая палец, закрывающий пипетку, сливайте из нее раствор до тех пор, пока его нижний мениск не совпадет с кольцевой меткой (или нулевым делением).
б) Держа закрытую пипетку строго вертикально, приподнимите ее так, чтобы капилляр оказался над поверхностью раствора и касался внутренней стенки колбы. Осторожно сдвигая палец, закрывающий пипетку, сливайте из нее раствор до тех пор, пока его нижний мениск не совпадет с кольцевой меткой (или нулевым делением).
в) Пипетку с раствором перенесите в колбу для титрования так, чтобы капилляр пипетки касался её стенки и отпустите палец, закрывающий пипетку, при этом раствор из пипетки перельется в колбу. После этого дотроньтесь 2 – 3 раза капилляром до поверхности раствора в колбе. Это необходимо для того, чтобы объём раствора, вытекшего из пипетки, точно соответствовал отмеренному объёму.
г) В колбу с раствором щёлочи добавьте 1 каплю раствора фенолфталеина и проведите ориентировочное титрование. Для этого, постоянно перемешивая содержимое колбы круговыми движениями, добавляйте в неё по каплям раствор из бюретки и внимательно следите за изменением окраски раствора. Когда ее интенсивность начнет ослабевать, уменьшите скорость добавления капель и тщательно перемешивайте раствор в колбе после добавления каждой капли. Титрование закончите лишь тогда, когда раствор в колбе полностью обесцветится.
д) Определите объем израсходованного на титрование раствора кислоты, произведя отчет по шкале бюретки сверху вниз (по нижнему мениску!). Запишите полученное значение объема раствора кислоты V 1, израсходованного на ориентировочное титрование:
V 1 = … см3.
е) Повторите титрование 3 – 4 раза, каждый раз используя новую сухую колбу и устанавливая уровень раствора в бюретке на нулевом делении. Запишите полученные значения объемов раствора кислоты:
V 2 = … см3; V 3 = … см3; V 4 = … см3.
Помните, что они могут различаться не более чем на 0,1 см3.
3. Р а с ч ё т м о л я р н о й к о н ц е н т р а ц и и э к в и в а л е н т о в к и с л о т ы в
п р и г о т о в л е н н о м р а с т в о р е
а) Из сходящихся (различающихся не более, чем на 0,1 см3) значений объёмов раствора кислоты, израсходованных на титрование, рассчитайте среднее значение объёма и запишите его в отчет: V ср.(кисл) = 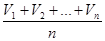 = … (см3).
= … (см3).
б) Рассчитайте молярную концентрации эквивалентов кислоты в приготовленном растворе и запишите в отчет: с э(кисл.) = 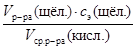 = … моль/дм3.
= … моль/дм3.
в) Рассчитайте относительную ошибку приготовления раствора кислоты:
e =  = … %.
= … %.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи расчётов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните необходимые расчёты и запишите их в отчёт.
6. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) Что характеризует молярная концентрация эквивалентов? Каковы её единицы?
б) Как связаны объёмы растворов двух реагирующих веществ с молярными концентрациями их эквивалентов в этих растворах? Где на практике используется эта зависимость?
в) Для чего используется и в чём заключается метод титрования?
г) Почему молярная масса эквивалентов одного и того же вещества может иметь разные значения? От чего зависит её величина?
д) Какова роль индикатора в процессе титрования?
е) Почему титрование следует проводить как минимум 3 раза?
ж) Что показывает величина относительной ошибки приготовления раствора? Почему концентрация кислоты, найденная методом титрования, может отличаться от заданного значения?
=======================================================================
ЛАБОРАТОРНАЯ РАБОТА № 5
«РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ»
Э к с п е р и м е н т а л ь н а я ч а с т ь
ОПЫТ № 1.Изучение характера диссоциации гидроксидов металлов
Выполнение:
В 2 пробирки налейте по 0,5 см3 раствора хлорида магния и добавьте по 0,5 см3 раствора щёлочи. В первую пробирку с образовавшимся осадком добавьте 1 см3 соляной кислоты, а в другую – 1 см3 раствора гидроксида натрия, содержимое обеих пробирок перемешайте стеклянной палочкой. Аналогично получите осадки гидроксидов цинка, никеля(II) и алюминия и исследуйте их отношение к растворам кислоты и щёлочи.
Задания:
Запишите все наблюдаемые эффекты. Составьте уравнения всех проведенных реакций в молекулярной, полной и сокращённой ионно-молекулярных формах. Сделайте выводы о характере диссоциации полученных вами гидроксидов и об их кислотно-основных свойствах.
ОПЫТ № 2.Смещение ионного равновесия в растворе уксусной кислоты (демонстрационный)
Выполнение:
В два стаканчика налейте по 20 см3 разбавленного раствора уксусной кислоты (с = 0,1 моль/дм3) и добавьте по 1 капле раствора метилоранжа. Затем в один из стаканчиков добавьте примерно 0,5 г ацетата натрия и перемешайте смесь стеклянной палочкой.
Задания:
Запишите наблюдаемые явления и объясните их. Сделайте вывод о влиянии концентрации ацетат-ионов на положение равновесия диссоциации уксусной кислоты.
ОПЫТ № 3.Смещение ионного равновесия в растворе аммиака кислоты (демонстрационный)
Выполнение:
В два стаканчика налейте по 20 см3 разбавленного раствора аммиака (с = 0,1 моль/дм3) и добавьте по 1 капле раствора фенолфталеина. Затем в один из стаканчиков добавьте примерно 0,5 г хлорида аммония и перемешайте смесь стеклянной палочкой.
Задания:
Запишите наблюдаемые явления и объясните их. Сделайте вывод о влиянии концентрации катионов аммония на положение равновесия диссоциации гидрата аммиака.
Сделайте общий вывод о влиянии концентраций ионов на положение равновесия диссоциации слабых электролитов.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2424; Нарушение авторских прав?; Мы поможем в написании вашей работы!