
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОПЫТ № 5. Совместный гидролиз двух солей
|
|
|
|
ОПЫТ № 4. Влияние температуры на степень гидролиза соли
Выполнение:
Налейте в пробирку 3 см3 дистиллированной воды и добавьте 0,05 г (один микрошпатель) ацетата натрия СH3COONa. Содержимое пробирки перемешайте до полного растворения кристаллов. В приготовленный раствор добавьте одну каплю раствора фенолфталеина. После этого нагрейте приготовленный раствор в пламени спиртовки до начала кипения.
Задания:
Запишите наблюдаемые явления и сравните интенсивность окраски холодного и горячего растворов. Напишите ионно-молекулярные уравнения гидролиза ацетата натрия. В каком направлении смещается равновесие гидролиза при повышении температуры? Почему это происходит? Сделайте вывод о влиянии температуры на степень гидролиза солей.
Выполнение:
Из числа предложенных выберите 3 – 4 пáры растворов солей, способных к совместному гидролизу. В одной пробирке смешайте растворы из первой пары; в другой пробирке – растворы из второй пары и т. д.
Задания:
Запишите наблюдаемые в каждом опыте явления. Составьте ионно-молекулярные уравнения совместного гидролиза выбранных солей. Почему в данном случае они гидролизуются необратимо? Сделайте вывод о природе солей, подвергающихся совместному гидролизу.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните задания ко всем опытам. Проведите необходимые расчёты и запишите их в отчёт.
6. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) Чем определяется способность солей к гидролизу? Какие соли не гидролизуются?
б) Взаимодействие между какими частицами лежит в основе гидролиза солей?
в) В каких случаях соли гидролизуются обратимо, а в каких – необратимо? Приведите по два примера соответствующих солей.
г) В чём заключается совместный гидролиз двух солей?
д) Что характеризует константа гидролиза соли? Как она рассчитывается? От каких факторов зависит её величина?
е) Что характеризует степень гидролиза соли? Как она связана с константой гидролиза? От каких факторов зависит величина степени гидролиза?
ж) Почему среда раствора Na2HPO4 щёлочная, а среда раствора KH2PO4 – кислая?
з) Как можно на практике ослабить гидролиз соли; усилить его?
=====================================================
ЛАБОРАТОРНАЯ РАБОТА № 7
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»
Т е о р е т и ч е с к а я ч а с т ь
1. Окислительные свойства перманганата калия KMnO4 в различных cредах (кислой, нейтральной и щелочной)
Перманганат калия KMnO4 – один из наиболее распространенных сильных окислителей, широко использующийся в химической промышленности, в лабораторной практике и в медицине. Состав продуктов его восстановления зависит, прежде всего, от среды растворов, в которых оно осуществляется. При этом, как правило:
1) В кислой среде KMnO4 восстанавливается до соединений 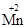 (MnSO4, MnCl2):
(MnSO4, MnCl2):
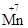 + 5e– →
+ 5e– → 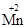 или
или 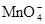 + 8H+ + 5e– →
+ 8H+ + 5e– → 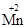 + 4H2O; E ° = 1,51 B.
+ 4H2O; E ° = 1,51 B.
2) В нейтральной среде KMnO4 восстанавливается до соединений 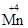 , состав которых условно выражается формулой MnО2:
, состав которых условно выражается формулой MnО2:
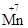 + 3e– →
+ 3e– → 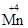 или
или 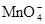 + 2H2О + 3e– → MnО2 + 4ОH—; E ° = 0,60 B.
+ 2H2О + 3e– → MnО2 + 4ОH—; E ° = 0,60 B.
3) В щелочной среде KMnO4 восстанавливается до соединений 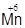 (K2MnO4, Na2MnO4):
(K2MnO4, Na2MnO4):
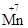 + 1e– →
+ 1e– → 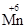 или
или 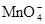 + 1e– →
+ 1e– → 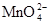 ; E ° = 0,56 B.
; E ° = 0,56 B.
При этом происходит резкое изменение окраски растворов в соответствии с данными таблицы 1:
Таблица 1. Окраска соединений марганца в зависимости от степени его окисления
| Степень окисления марганца | Форма существования в растворе или в осадке | Примеры соединений | Окраска раствора или осадка |
| +7 | 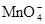 (р-р) (р-р)
| KMnO4, NaMnO4 | розово-фиолетовая |
| +6 | 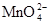 (р-р) (р-р)
| K2MnO4, Na2MnO4 | изумрудно-зелёная |
| +4 | 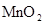 (осадок) (осадок)
| MnО2 | бурая |
| +2 | 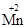 (р-р) (р-р)
| MnSO4, MnCl2 | практич. бесцветная |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2240; Нарушение авторских прав?; Мы поможем в написании вашей работы!