
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОПЫТ 8. Окисление этанола дихроматом калия в присутствии серной кислоты
|
|
|
|
Опыт 7. Конпропорционирование иодида и иодата в кислой среде
Выполнение: В раствор, полученный в предыдущем опыте (содержащий ионы 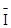 и
и 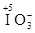 ), добавьте равный объём раствора серной кислоты.
), добавьте равный объём раствора серной кислоты.
Задания: Запишите наблюдаемые явления. Чем обусловлено появление окраски? Составьте уравнение соответствующей ОВР, укажите окислитель и восстановитель. Какие вещества могут вступать в реакции конпропорционирования?
Выполнение: В пробирку налейте раствор дихромата калия объёмом ~1см3 и добавьте равный объем раствора серной кислоты. Прилейте этиловый спирт объёмом ~0,5 см3 и полученную смесь осторожно нагрейте пламенем спиртовки (не кипятите!!!) до изменения окраски раствора. Осторожно определите запах продукта окисления этанола – уксусного альдегида, выделяющегося из реакционной смеси. Что напоминает Вам этот запах?
Задания: Учитывая, что дихромат калия в кислой среде восстанавливается до солей хрома (III), придающих раствору зеленый цвет, составьте уравнение соответствующей реакции, укажите окислитель и восстановитель. Приведите примеры органических веществ, обладающих сильными восстановительными свойствами.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните задания ко всем опытам.
6. Выполните необходимые расчёты и запишите их в отчёт.
7. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) Какой главный фактор определяет состав продуктов восстановления перманганата калия?
б) Какие продукты образуются в результате восстановления перманганат-ионов в кислой, в нейтральной и в щёлочной средах? Какие визуальные эффекты сопровождают эти процессы?
в) Чем обусловлена окислительно-восстановительная двойственность пероксида водорода? Что образуется при его окислении; при восстановлении?
г) Какие ОВР относятся к реакциям дисмутации, а какие – к реакциям конмутации? В чём сходство этих реакций и чем они принципиально отличаются?
д) В чём заключаются различия ОВР межмолекулярного и внутримолекулярного типов?
е) Какие свойства – восстановительные или окислительные наиболее характерны для органических веществ? Почему?
=======================================================================
ЛАБОРАТОРНАЯ РАБОТА № 8
«комплексные соединения (КС)»
Э к с п е р и м е н т а л ь н а я ч а с т ь
Опыт 1. Образование анионного КС – тетраиодовисмутата(III) калия.
Выполнение:
В пробирку с раствором нитрата висмута(III) добавляйте по каплям равный объем раствора иодида калия, внимательно наблюдая за изменениями в пробирке.
Задания:
Запишите наблюдаемые явления. Отметьте окраску выпавшего осадка и образовавшегося затем прозрачного раствора. Чем обусловлены эти изменения? Напишите уравнения протекающих реакций в полной и сокращенной ионно-молекулярной формах, если в молекулярной форме они имеют вид:
Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3; BiI3 + KI → K[BiI4].
Напишите уравнения первичной и вторичной диссоциации полученного КС а также выражение общей константы нестойкости образовавшегося комплексного аниона.
Опыт 2. Образование анионного КС – тетратиоцианокобальтата(II) аммония и его разрушение.
Выполнение:
В пробирку с раствором хлорида кобальта(II) прилейте равный объём водно-ацетонового раствора роданида аммония. В полученный раствор добавьте равный объём воды.
Задания:
Запишите наблюдаемые явления. Отметьте изменение окраски растворов. Чем оно обусловлено? Напишите уравнения протекающих реакций в полной и сокращенной ионно-молекулярной формах, если в молекулярной форме они имеют вид:
[Co(H2O)6]Cl2 + NH4NCS 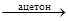 (NH4)2[Co(H2O)2(NCS)4] + NH4Cl + H2O;
(NH4)2[Co(H2O)2(NCS)4] + NH4Cl + H2O;
(NH4)2[Co(H2O)2(NCS)4] + 4H2O  [Co(H2O)6] (NCS)2 + 2NH4NCS.
[Co(H2O)6] (NCS)2 + 2NH4NCS.
Сделайте вывод об устойчивости комплексного иона [Co(H2O)2(NCS)4]2– в водном растворе. Напишите уравнения первичной и вторичной диссоциации КС (NH4)2[Co(H2O)2(NCS)4] а также выражение общей константы нестойкости его комплексного аниона.
Опыт 3. Образование катионного КС – сульфата тетраамминдиаквамеди(II)
Выполнение: В пробирку с раствором сульфата меди(II) добавьте равный объём концентрированного раствора аммиака (вытяжной шкаф!).
Задания:
Запишите наблюдаемые явления. Отметьте изменение окраски растворов. Чем оно обусловлено? Напишите уравнение протекающей реакции в полной и сокращенной ионно-молекулярной формах, если в молекулярной форме оно имеет вид:
[Cu(H2O)6]SO4 + 4NH3 · H2O → [Cu(NH3)4(Н2O)2]SO4 + 8H2O.
Напишите уравнения первичной и вторичной диссоциации КС [Cu(NH3)4(Н2O)2]SO4 а также выражение общей константы нестойкости его комплексного катиона.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 6659; Нарушение авторских прав?; Мы поможем в написании вашей работы!