
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні характеристики ковалентного зв’язку в органічній молекулі
|
|
|
|
Конспект лекційного заняття
Основні поняття
Хімічний зв’язок. Взаємний вплив атомів в органічних сполуках
ЛЕКЦІЯ № 3
Ковалентний зв'язок, напрямленість, полярність, поляризованість ковалентного зв’язку, індукційний, мезомерний ефект, взаємний вплив атомів.
План лекційного заняття:
1. Основні характеристики ковалентного зв’язку в органічній молекулі
2. Поняття про взаємний вплив атомів
3. Індукційний ефект в органічних молекулах
4. Мезомерний ефект в органічних молекулах
Література:
1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Высшая школа. – 1979. – 832с.
2. Домбровський А.В., Найдан В.М. Органічнахімія. – К.: Вища школа. – 1992. – 503с.
3. Кери Ф., Сандберг Р. Углубленный курс органической химии: в 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1134с.
4. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии: В 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1020с.
5. Пальм В.А. Введение в теоретическую органическую химию. – М.:Высшая школа, 1974.
6. Перекалин В.В., Зонис С.А. Органическая химия. – М., 1982.
7. Сайкс П. Механизмы реакций в органической химии. – М.: Хрия, 1973.
8. Самусенко Ю.В., Шиян Н.І. Органічна хімія. – Полтава, 2003.
9. Смолина Т.А., Васильева Н.В., Куплетская Н.Б. Практические работи по органической химии. – М., 1986.
10. Тейлор Г. Основы органической химии для студентов нехимических специальностей: пер. с англ. – М.: Мир. – 1989. – 384с.
Ковалентний зв’язок між атомами характеризується енергією, довжиною, полярністю, поляризованістю і напрямленістю в просторі.
Енергія, яка необхідна для розщеплення окремого зв’язку з утворенням двох нейтральних атомів, називається енергією дисоціації зв’язку, її виражають у джоулях на моль. Часто неможливо визначити енергію, необхідну для розриву окремого зв’язку. Тому замість енергії дисоціації зв’язку використовують середню величину, яку називають енергією зв’язку.
Довжина зв’язку – це та віддаль між ядрами атомів, що утворюють хімічний зв’язок, на якій сили притягання урівноважуються силами відштовхування.
Ковалентні зв’язки можуть бути полярними і неполярними. В неполярних ковалентних зв’язках область максимальної електронної густини (іншими словами, пара електронів) розташована на однаковій віддалі від ядер обох атомів. Наприклад, ковалентний зв’язок у молекулі гідрогену є неполярним. Переважна більшість ковалентних зв’язків має полярний характер. Це означає, що область максимальної електронної густини розташована не точно посередині між ядрами атомів, а в більшій або меншій мірі зміщена до одного з них. Напрям зміщення електронної густини зв’язку визначається за електронегативністю атомів.
Електронегативність характеризує здатність атомів даного елемента в сполуці відтягувати електрони від сусідніх атомів і визначає додаткову електронну спорідненість тих атомів, які вже заповнили вакантні орбіталі і після цього ще намагаються відтягнути спільні електрони на себе. Електронегативність атомів можна визначити за допомогою шкали електронегативностей, запропонованої Л. Полінгом. Найбільш електронегативним є Флуор, тому в сполуках з іншими елементами електронна пара зв’язку завжди зміщена в його бік. Карбон знаходиться посередині шкали і залежно від валентного стану може виявляти різну електронегативність. Більшість елементів, які входять до складу органічних речовин, виявляють більшу електронегативність, ніж він, тому атом карбону в цих речовинах часто несе частковий позитивний заряд.
Полярність різних зв’язків можна кількісно характеризувати різницею електронегативностей сполучених між собою атомів. Чим більша ця різниця, тим полярніший даний зв’язок, тим він більш активний у хімічних реакціях.
Внаслідок різної електронегативності атомів у хімічному зв’язку (в молекулі) порушується симетрія розподілу зарядів (електронної густини). Одні атоми, в результаті зміщення до них електронної густини, набувають часткового негативного заряду, інші атоми, внаслідок зміщення електронної густини від них, набувають часткового позитивного заряду. Ці часткові (неповні) заряди, величина яких становить частки заряду електрона, позначають грецькою буквою “дельта” (d+ і d-). Наприклад, ковалентний зв’язок між атомами карбону і гідрогену (СН) полярний, оскільки карбон більш електронегативний і електронна густина зміщена до його атома, що схематично показано стрілкою. В результаті на атомі карбону виникає частковий (менший від одиниці) заряд d-, а на атомі гідрогену – однаковий за абсолютною величиною, але протилежний за знаком заряд d+. Полярність зв’язку оцінюють, виходячи переважно з величини дипольного моменту молекули.
Дипольний момент m молекули є добутком абсолютного значення заряду q на віддаль l між центрами маси всіх позитивних і негативних зарядів молекули: m = ql. Дипольний момент вимірюють у дебаях (D) або в кулон-метрах (Кл • м).
Дипольний момент – векторна величина. Його позначають символом 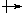 . У хімічній літературі дипольний момент прийнято вважати напрямленим від позитивного кінця диполя до його негативного кінця. Для двохатомної молекули дипольний момент зв’язку є одночасно і дипольним моментом молекули. Дипольний момент молекули, яка має кілька полярних зв’язків, виражається векторною сумою дипольних моментів окремих зв’язків. Зв’язок тим полярніший, чим більше зміщена спільна пара електронів до одного з атомів, тобто чим більші часткові заряди атомів і чим більша довжина диполя. Тому в молекулах, подібних за будовою дипольний момент зростає із збільшенням різниці електронегативностей атомів, які входять до їх складу.
. У хімічній літературі дипольний момент прийнято вважати напрямленим від позитивного кінця диполя до його негативного кінця. Для двохатомної молекули дипольний момент зв’язку є одночасно і дипольним моментом молекули. Дипольний момент молекули, яка має кілька полярних зв’язків, виражається векторною сумою дипольних моментів окремих зв’язків. Зв’язок тим полярніший, чим більше зміщена спільна пара електронів до одного з атомів, тобто чим більші часткові заряди атомів і чим більша довжина диполя. Тому в молекулах, подібних за будовою дипольний момент зростає із збільшенням різниці електронегативностей атомів, які входять до їх складу.
Важливою характеристикою хімічних зв’язків є їх полярність, яка часто визначає фізичні й хімічні властивості органічних речовин. Від наявності того чи іншого часткового заряду на атомі залежить його реакційна здатність. Полярність зв’язку в молекулах органічних речовин – нестала величина. Вона може змінюватись під впливом багатьох факторів: природи атакуючого даний зв’язок реагенту, характеру розчинника тощо. Тому крім полярності, яка характеризує хімічні зв’язки в статичному стані, кожний зв’язок має ще й поляризованість. Поляризованість зв’язку – це його здатність змінювати свою полярність під дією зовнішнього електромагнітного поля.
Ковалентні зв’язки завжди мають певну напрямленість у просторі. Між напрямами ковалентних зв’язків атома утворюється валентний кут. Наприклад, у молекулі метану цей кут становить 109°28’, етилену – 120°, ацетилену – 180° і т.д.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1247; Нарушение авторских прав?; Мы поможем в написании вашей работы!