
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомологічний ряд алканів та циклоалканів
|
|
|
|
Конспект лекційного заняття
Основні поняття
Кислотні та основні властивості органічних сполук. Класифікація органічних реакцій і реагентів
ЛЕКЦІЯ №5
Кислотні властивості, основні властивості, реакції приєднання, реакції заміщення, гомолітичні, гетеролітичні реакції.
План лекційного заняття:
1. Гомологічний ряд алканів та циклоалканів.
2. Номенклатура та ізомерія.
3. Хімічні та фізичні властивості.
4. Добування алканів та циклоалканів.
Література:
1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Высшая школа. – 1979. – 832с.
2. Домбровський А.В., Найдан В.М. Органічнахімія. – К.: Вища школа. – 1992. – 503с.
3. Кери Ф., Сандберг Р. Углубленный курс органической химии: в 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1134с.
4. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии: В 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1020с.
5. Пальм В.А. Введение в теоретическую органическую химию. – М.:Высшая школа, 1974.
6. Перекалин В.В., Зонис С.А. Органическая химия. – М., 1982.
7. Сайкс П. Механизмы реакций в органической химии. – М.: Хрия, 1973.
8. Самусенко Ю.В., Шиян Н.І. Органічна хімія. – Полтава, 2003.
9. Смолина Т.А., Васильева Н.В., Куплетская Н.Б. Практические работи по органической химии. – М., 1986.
10. Тейлор Г. Основы органической химии для студентов нехимических специальностей: пер. с англ. – М.: Мир. – 1989. – 384с.
Найпростіші органічні сполуки, які складаються з Карбону і Гідрогену, називаються вуглеводнями. Вуглеводні, які мають відкритий ланцюг карбонових атомів, називаються аліфатичними, або вуглеводнями жирного ряду. Численна група аліфатичних вуглеводнів поділяється на дві підгрупи: 1) насичені, або граничні, вуглеводні; 2) ненасичені, або неграничні, вуглеводні, які містять подвійні чи потрійні зв’язки.
Насиченими називають такі вуглеводні, атоми Карбону в молекулах яких сполучені між собою простими (одинарними) s-зв’язками. Всі інші одиниці валентності атомів Карбону в цих сполуках зайняті (насичені) атомами Гідрогену. Атоми Карбону в молекулах насичених вуглеводнів перебувають у першому валентному стані, тобто в стані sp3-гібридизації. Насичені вуглеводні називають ще алканами, або парафінами. Парафінами ці органічні сполуки називають тому, що довгий час їх вважали малореакційноздатними. Стара назва насичених вуглеводнів – аліфатичні, або жирні, вуглеводні (від лат. alifatic – жирний). Ця назва походить від назви перших вивчених сполук, які колись відносили до цих речовин, – жирів.
Найпростішим представником насичених вуглеводнів є метан СН4:

Наведена структурна формула метану не відбиває просторової будови молекули. Для розгляду цієї будови необхідно згадати про форми електронних хмаринок і електронну будову атома Карбону. Електронна будова атома Карбону зображується в такий спосіб: 1s22s22p2 або схематично:

Як видно, на зовнішній оболонці є два неспарених електрони, отже Карбон повинен бути двохвалентним. Однак, у переважній більшості випадків Карбон в органічних сполуках чотирьохвалентний. Це пов'язано з тим, що при утворенні ковалентного зв'язку атом Карбону переходить у збуджений стан, при якому електронна пара на 2s-орбіталі роз'єднується й один електрон займає вакантну p-орбіталь. Схематично:

|

| 
|
У результаті є вже не два, а чотири неспарених електрони. Оскільки ці чотири електрони різні (2s- і 2p-електрони), то повинні б бути різні й зв'язки в атома Карбону, однак доведено, що зв'язки в молекулі метану рівнозначні. Виявляється при “змішуванні” чотирьох орбіталей збудженого атома Карбону (однієї 2s- і трьох 2p-орбіталей) утворюються чотири рівноцінні sp3-гібридні орбіталі. Вони мають форму гантелі, одна з половин якої значно більше іншої. Внаслідок взаємного відштовхування sp3-гібридні орбіталі спрямовані в просторі до вершин тетраедра й кути між ними рівні 109°28' (найбільш вигідне розташування).

|
| Рис.1. Модель sp3-гібридного стану електронної оболонки атома Карбону. |
sp3- Гібридизація характерна для атомів Карбону в насичених вуглеводнях (алканах) – зокрема, у метані.

|
| Рис.2. Схема електронної будови молекули метану. |
Із рис. 2 видно, що кожна sp3-гібридна орбіталь при перекриванні з s-орбіталлю атомів Гідрогену утворює із ними чотири, так звані, s-зв'язки. s-Зв'язок – це одинарний ковалентний зв'язок, утворений при перекриванні орбіталей по прямій, що з'єднує ядра атомів, з максимумом перекривання на цій прямій. Атом Карбону в молекулі метану розташований у центрі тетраедра, атоми Гідрогену – у його вершинах, всі валентні кути між напрямками зв'язків рівні між собою й становлять кут 109°28'. Слід зазначити, що в молекулі етану (CH3–СH3) одна із семи -зв'язків (С–С) утворюється в результаті перекривання двох sp3-гібридних орбіталей атомів Карбону.
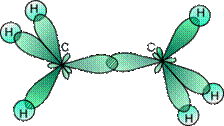
|
| Рис. 3. Утворення молекули етану перекриванням двох гібридних електронних хмаринок атомів Карбону. |
Насичені вуглеводні утворюють ряд сполук, в якому наступний член відрізняється за складом від попереднього на постійну величину, що дорівнює СН2.Такий ряд називається гомологічним, а окремі члени його – гомологами (табл.1).
Таблиця 1.
Фізичні константи деяких насичених вуглеводнів.
| Назва | Формула | Тпл, оС | Ткип, оС |
| Метан | 
| -182,5 | -101,5 |
| Етан | 
| -173,3 | -88,6 |
| Пропан | 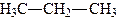
| -187,7 | -42,7 |
| Бутан | 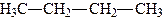
| -138,3 | -0,5 |
| Пентан | 
| -129,7 | +36,7 |
| Гексан | 
| -95,3 | 68,7 |
| Гептан | 
| -90,6 | 98,4 |
| Октан | 
| -56,8 | 125,7 |
| Нонан | 
| -53,5 | 150,8 |
| Декан | 
| -29,6 | 174,1 |
| Пентадекан | 
| +10 | 270,5 |
| Ейкозан | 
| 36,8 | 342,7 |
| Пентакозан | 
| 53,7 | |
| Триаконтан | 
| 65,8 | 446,4 |
| Гектан | 
| 115,2 | - |
Постійна різниця в складі між суміжними членами гомологічного ряду СН2 називається гомологічною різницею. Всі сполуки гомологічного ряду насичених вуглеводнів виражаються загальною формулою СnН2n+2 (n = 1, 2, 3, 4…).
Явище існування гомологів і гомологічних рядів дістало в органічній хімії назву гомології. Гомологія властива й іншим класам органічних речовин, причому для всіх гомологічних рядів гомологічною різницею є група СН2.
Назви перших чотирьох насичених виникли випадково. Починаючи з С5Н12, назви алканів утворені від грецьких або латинських числівників, які вказують кількість карбонових атомів у молекулі даного насиченого вуглеводню, з додаванням до цих назв суфіксу – ан (табл. 1).
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 2563; Нарушение авторских прав?; Мы поможем в написании вашей работы!