
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бензол
|
|
|
|
Конспект лекційного заняття
Основні поняття
Моноядерні арени. Реакції електрофільного заміщення в аренах. Галогено-, нітро-, сульфопохідні моноядерних аренів
Бензол, арени, реакції Вюрца-Фелінга, Фріделя.
План лекційного заняття:
1. Будова молекули бензолу.
2. Властивості бензолу.
3. Класифікація аренів.
4. Характеристика гомологів бензолу.
5. застосування гомологів бензолу.
6. Реакції Вюрца-Фелінга та Фріделя.
Література:
1. Ластухін Ю.О., Воронов С.А. Органічна хімія. – Львів: Центр Європи, 2001. – С. 71-127, 190-200.
2. Нейланд О.Я. Органическая химия. – М.: Высшая школа, 1990. – С. 9-13, 22-38, 59-61, 81-85, 86-89, 92-95, 103-105, 130, 145, 177-179, 225-228.
3. Перекалин В.В., Зонис С.А. Органическая химия. – М.: Просвещение, 1972. – С. 6-17, 18-25, 29-38, 47-48, 54-58, 76, 78-79, 105, 160-161, 177-179.
4. Петров А.А., Бальян Х.В., Трощенко А.Б. Органическая химия. – М.: Высшая школа, 1973. – С. 5-11, 20-43, 44-48, 64-65, 248-257.
5. Чирва В.Я., Ярмолюк С.М., Толкачова Н.В., Земляков О.Є. Органічна хімія. – Львів: БаК, 2009. – С. 81-131.
Ароматичними вуглеводнями називаються сполуки, молекули яких містять стійкі циклічні структури бензольні ядра. Термін "ароматичні сполуки" виник у початковий період розвитку органічної хімії, коли встановили, що речовини ряду бензолу виділяються з природних ароматичних речовин.
Бензол є найпростішим ароматичним вуглеводнем. Його склад відповідає формулі С6Н6.
Будова молекули бензолу. Перша найбільша вдала структурна формула бензолу була запропонована в 1865 р. німецьким хіміком Кекуле. Згідно з його уявленнями зв’язки між атомами вуглецю, замкненими в шестичленний цикл. Ця формула показує рівноцінність усіх атомів вуглецю і водню, які входять в молекулу бензолу, що було доведено експериментально (див. Формулу 1). Використовуючи формулу 1, слід враховувати, що бензол не можна відносити до звичайних ненасичених сполук, оскільки він значно відрізняється від них за властивостями, наприклад, не приєднує бром.
Для позначення бензолу прийнято також формулу 2 і спрощену формулу Кекуле 3. Остання формула використовуватиметься при подальшому викладенні матеріалу:
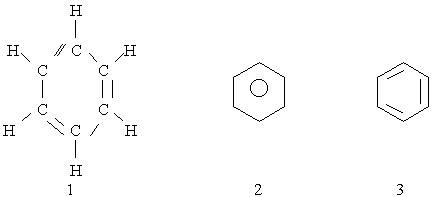
Згідно з сучасними електронними уявленнями будова молекули бензолу пояснюється так. У цій молекулі орбіталі зовнішнього енергетичного рівня кожного атома вуглецю перебувають у стані sp2 - гібридизації. Електрони, що перебувають на гібридизованих орбіталях, утворюють o -зв'язки між сусідніми атомами вуглецю і s- зв¢язки вуглець-водень. sp2 - Гібридизовані орбіталі розміщуються під кутом 120° одна до одної, тому в молекулі бензолу атоми вуглецю розміщуються в кутах правильного шестикутника.
р-Орбіталі шести атомів вуглецю в бензолі, які не беруть участі в гібридизації, розміщуються перпендикулярно до площини бензольного кільця і перекриваються одна з одною з верху і з низу цієї площини. Електрони, що перебувають на цих орбіталях, утворюють єдину стійку p- електронну систему. Так виникає хімічний зв’язок, який об'єднує всі шість атомів вуглецю в молекулі бензолу.
Молекула С6Н6 плоска, всі атоми вуглецю розміщені на однакових віддалях один від одного, утворюючі правильний шестикутник.
Властивості. Бензол - безбарвна рідина що має характерний запах. Легко переходить у твердий стан: температура плавлення бензолу становить +5,5°С, температура кипіння +80,1°С. У воді бензол практично не розчиняється але є хорошим розчинником багатьох органічних речовин.
Хімічні властивості бензолу та інших ароматичних сполук характеризуються рядом особливостей.
Для бензолу характерні реакції заміщення атомів водню в бензольному кільці. Ці реакції відбуваються за механізмом електрофільного заміщення. Електрофільна частинка Х+ взаємодіє з p - електронами молекули бензолу, утворюючи p-комплекс, який переходить у s- комплекс. В s- комплексі частинка Х+ сполучена з одним з атомів вуглецю, в результаті ароматичний характер молекули порушується. Далі від s- комплексу відщеплюється протон і відновлюється ароматичний характер ядра. Механізм цієї реакції можна проілюструвати такою схемою:
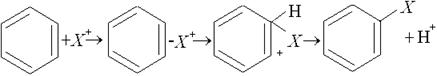
p - комплекс s - комплекс
На відміну від ненасичених сполук типу алкенів і алкінів, бензол дуже стійкий проти окислення, важко вступає в реакції приєднання. Розглянемо найбільш характерні для ароматичних вуглеводнів реакції.
1. Нітрування. При дії на бензол нітруючої суміші (суміш концентрованих азотної і сірчаної кислот) відбувається заміщення водню в ядрі бензолу на групу NO2; цей процес називається нітруванням:
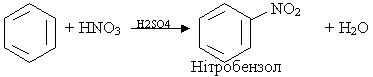
Реакція відбувається за механізмом електрофільного заміщення. Роль електрофільної частинки відіграє іон NO2+, який утворюється в результаті реакції:
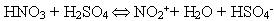
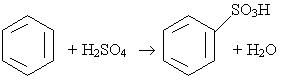
2. Сульфування. Водень в бензольному ядрі може бути заміщений на сульфогрупу SO3H під дією концентрованої сірчаної кислоти; цей процес називається сульфуванням:
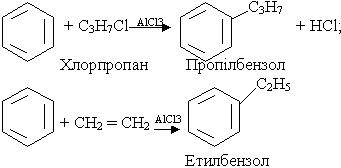
3. Алкілування. В молекулу бензолу замість водню можна ввести алкільний радикал. Процес алкілування можна здійснити дією на бензол галагенопохідної алкану чи олефіну при наявності каталізатора (хлорид алюмінію AlCl3):
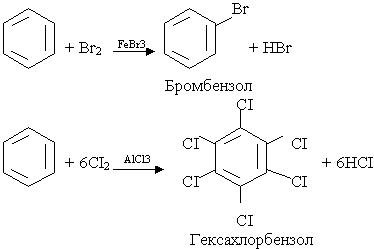
4. Галогенування. Заміщення водню в бензольному ядрі на хлор чи бром здійснюється при взаємодії бензолу з галогенами за участю каталізатора. Реакцію можуть каталізувати FeCl3 (або FeBr3) і AlCl3, при цьому утворюються різні продукти:
Під час інтенсивного опромінення реакційної системи світлом бензол може приєднувати хлор:
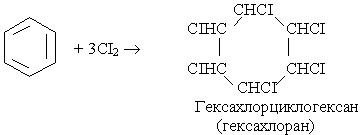
На відміну від наведених вище реакцій галогенування, в яких атом хлору чи брому заміщує водень в бензольному ядрі, в цій реакції атоми хлору приєднуються до всіх атомів вуглецю. В результаті руйнується p- електронна система бензолу і утворюється галагенопохідна циклоалкану
5. Гідрування. Одна з не багатьох реакцій приєднання, в яку може вступати бензол, - реакція гідрування при наявності платинових або нікелевих каталізаторів:
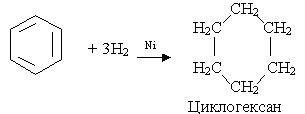
Добування. Бензол виділяють переважно з нафти та кам'яного вугілля при виробництві коксу.
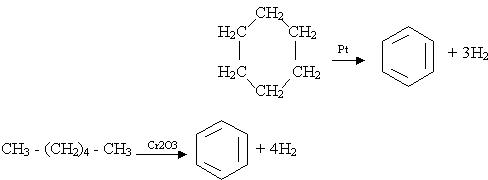
Бензол можна добути з циклогексану за реакцією дегідрування з участю платини як каталізатора або шляхом циклізації і дегідрування нормального гексану при наявності Cr2O3:
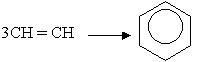
Бензол утворюється також під час пропускання ацетилену над розжареним активним вугіллям:
Застосування. Бензол є важливою сировиною для органічного синтезу його використовують при добуванні багатьох інших ароматичних сполук. Бензол застосовують в виробництві барвників, пластмас, пестицидів, вибухових речовин, ліків; його використовують як розчинник лаків, фарб.
Бензол входить до складу палива, яке використовується в двигунах внутрішнього згоряння.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1312; Нарушение авторских прав?; Мы поможем в написании вашей работы!