
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дослід 2. Визначення карбону і гідрогену окисненням речовини оксидом купруму (ІІ)
|
|
|
|
Якісний елементний аналіз органічних сполук
Лабораторна робота №1
Найбільш розповсюдженими елементами в органічних сполуках, крім карбону, є гідроген, оксисен, нітроген, сульфур, фосфор та галогени. Звичайні методи якісного аналізу не можуть бути застосовані для аналізу органічних сполук. Для виявлення карбону, нітрогену, сульфуру та інших елементів органічну сполуку руйнують, при цьому більшість елементів переходить до неорганічних сполук. Наприклад, карбон входить до складу оксиду карбону (IV), гідроген – до складу води, нітроген – до складу ціаніду натрію, сульфур – до складу сульфіду натрію, галогени – до складу галогені дів натрію. Далі елементи відкривають звичайними методами аналітичної хімії.
Дослід 1. Визначення карбону пробою на обвуглювання. (Тяга!)
Реактиви: цукор, папір, бензен, 1%-й розчин сульфатної кислоти, концентрована сульфатна кислота.
Обладнання: фарфорова чашка, фарфоровий трикутник, скальпель, хімічний стакан (50 мл), ступка з товкачиком.
Обвуглювання – найпростіша спроба для визначення карбону в органічних сполуках. Деякі органічні сполуки обвуглюються (чорніють) при прожарюванні, в інших випадках обвуглювання спостерігається при дії речовин, що відщеплюють воду, наприклад концентрованої сульфатної кислоти.
а) Розтирають в ступці 25 г швидкорозчинного цукру, додають 3 мл води і переносять в хімічний стакан. Потім при перемішуванні скляною паличкою додають 12,5 мл концентрованої сульфатної кислоти. Коли починається обвуглювання паличку виймають. Суміш здимається, чорний пористий «пиріг» піднімається вгору.
б) На білому чи фільтрувальному папері роблять надпис 1%-ним розчином сульфатної кислоти. При висиханні розчину надпис не видно. При обережному нагріванні паперу над полум’ям пальника ділянки паперу, що були змочені кислотою, обвуглюються – з’являється надпис.
в) В фарфорову чашку наливають 3 мл бензену і підпалюють його. Бензен горить коптячим полум’ям, частина карбону виділяється у вигляді сажі. Завершіть рівняння реакції:
C6H6 + 4,5 O2 =
Реактиви: цукор (попередньо висушений), оксид купруму (ІІ) – порошок, вапнякова (або баритова) вода, безводний сульфат купруму (ІІ) – свіжопрожарений.
Обладнання: вигнуті газовідвідні трубки з пробками для пробірок, вата.
Окиснення органічної речовини оксидом купруму (ІІ) призводить до утворення оксиду карбону (IV) і води за рівнянням:
C12H22O11 + 24CuO = 12CO2 + 11H2O + 24Cu
В суху пробірку з газовідвідною трубкою поміщають 0,2-0,3 г розтертого в порошок сухого цукру і 1-2 г оксиду купруму (ІІ). Вміст пробірки ретельно перемішують, зверху суміш засипають шаром оксиду купруму (ІІ) – приблизно 1 г. У верхню частину пробірки (під пробку) поміщають маленький жмуток вати, на який насипають невелику кількість безводного сульфату купруму (ІІ). Пробірку закривають пробкою з газовідвідною трубкою і закріпляють її горизонтально в лабораторному штативі. Вільний кінець газовідвідної трубки опускають в пробірку з вапняковою (баритовою) водою таким чином, щоб трубка майже торкалася поверхні розчину. Спочатку прогрівають всю пробірку, потім сильно нагрівають ту частину, де знаходиться реакційна суміш.
Відмітьте, що відбувається з вапняковою водою. Чому сульфат купруму (ІІ) змінює забарвлення?
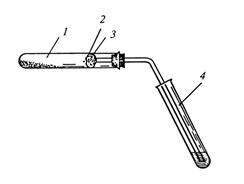
Рис.6.Прилад для одночасного визначення карбону і гідрогену
в органічній речовині:
1 – суха пробірка із сумішшю сахарози і оксиду купруму (ІІ);
2 – вата; 3 – безводний сульфат купруму; 4 – пробірка з вапня-
-ковою водою
Дослід 3. Відкривання нітрогену сплавленням речовини з металевим натрієм. (Тяга! Захисні окуляри!)
Реактиви: сечовина, металевий натрій, 5%-й розчин сульфату феруму (ІІ), 1%-й розчин хлориду феруму (ІІІ), 10%-й розчин хлоридної кислоти, етиловий спирт.
Обладнання: фільтрувальний папір, лійки, скальпель, пінцет.
Принцип методу полягає в тому, що при сплавленні з металевим натрієм органічна речовина розкладається, а нітроген, що містився в ній, утворює з карбоном і натрієм ціанід натрію. Цю сполуку виявляють шляхом перетворення її в берлінську блакить:
FeSO4 + 2NaOH = Fe (OH)2 + Na2SO4 } Утворення гідроксидів
феруму
FeCl3 + 3NaOH = Fe (OH)3 + 3NaCl
Fe (OH)2 + 2NaCN = Fe (CN)2 + 2NaOH } Утворення гексаціаноферату
Fe (CN)2 + 4Na CN = Na4[Fe (CN)6] натрію
Fe (OH)3 + 3HCl = FeCl3 + 3H2O } Утворення берлінської
блакиті
3Na4[Fe (CN)6] + 4FeCl3 = Fe4[Fe (CN)6]3 = 12NaCl
В суху пробірку поміщають декілька кристалів сечовини (H2N-CO-NH2) і шматочок (з сірникову головку) металевого натрію. Нижню частину пробірки нагрівають до появи спалаху. (Захисні окуляри!). Пробірку нагрівають на сильному вогні і зразу ж опускають в хімічний стан з 10-15 мл дистильованої води, легенько постукуючи по дну стакана. При цьому пробірка тріскається і вода попадає в пробірку (Обережно! Можливий повторний спалах!). Розчин, що утворився в стакані фільтрують через паперовий фільтр в чисту пробірку. До фільтрату додають 2-3 краплі 5%-го розчину FeSO4 і 1 краплю 1%-го розчину FeCl3. Випадають осади гідроксидів феруму. Вміст пробірки перемішують і підкисляють розчином хлоридної кислоти. Осад суміші гідроксидів феруму розчиняється і з’являється синє-зелене забарвлення.
Чому утворення берлінської блакиті відбувається в кислому середовищі?
Дослід 4. Відкривання сульфуру сплавленням органічної речовини з металевим натрієм. (Тяга! Захисні окуляри!)
Реактиви: тіосечовина, металевий натрій, 2%-й розчин ацетату свинцю, 2%-й розчин нітропрусиду натрію (свіже виготовлений), 10%-й розчин хлоридної кислоти.
Обладнання: фільтрувальний папір, лійки, скальпель, пінцет.
Сульфур відкривают в органічній сполуці подібно нітрогену. Спочатку руйнують органічну сполуку сплавленням з металевим натрієм. При цьому сульфур утворює з металевим натрієм сульфід натрію (Na2S). Далі відкривають сульфід-йон (S2- ) звичайними якісними реакціями.
Після фільтрування водного розчину його поділяють на дві частини.
а) До першої частини розчину додають 0,5 мл 2%-го розчину нітропрусиду натрію. З’являється інтенсивне червоно-фіолетове забарвлення внаслідок утворення нової комплексної солі:
Na2S + Na2[Fe (CN)5NO] = Na4[Fe (CN)5NOS]
б) До другої частини розчину додають 2-3 мл 10%-ної хлоридної кислоти. Пробірку з реакційною сумішшю накривають клаптиком фільтрувального паперу попередньо змоченого розчином ацетату свинцю. Вміст пробірки обережно нагрівають на газовому пальнику. Через деякий час на фільтрувальному папері з’являється чорна пляма сульфіду свинцю:
Na2S + 2HCl = 2NaCl + H2S
H2S + (CH3COO)2Pb = PbS + 2CH3COOH
Дослід 5. Відкривання галогенів внаслідок руйнування речовини спалюванням. ( Тяга!)
Реактиви: хлороформ, 1%-й розчин аргентум нітрату.
Обладнання: фільтрувальний папір, стакан (150 мл), пінцет.
Хімічний стакан ополіскують дистильованою водою. Смушку фільтрувального паперу змочують хлороформом і підпалюють. (Тяга!); тримають над нею перевернутий догори дном вологий стакан. Після того, як папір згорить стакан перевертають і доливають в нього 2-3 мл дистильованої
води. Після цього додають декілька крапель розчину аргентум нітрату. Утворюється білий осад аргентум хлориду:
HCl + AgNO3 = HNO3 + AgCl
Дослід 6. Проба Бейльштейна* на галогени.
Реактиви: хлороформ, бромбензен, йодоформ і т.п.
Обладнання: мідний дріт довжиною до 10 см.
При прожарюванні органічної речовини з оксидом купруму (ІІ) відбувається його окиснення. Карбон при цьому перетворюється в оксид карбону (IV), гідроген – у воду, а галогени утворюють з купрумом леткі галогеніди, які забарвлюють полум’я в яскраво-зелений колір.
Мідний дріт на одну третину намотують на скляну паличку, утворюючи спіраль. Тримаючи дріт за рівний кінець прожарюють спіральну частину на полум’ї пальника. Після охолодження на спіраль набирають невелику кількість речовини, що досліджується і вносять в полум’я добре відрегульованого пальника. При наявності в речовині галогенів полум’я набуває зеленого забарвлення.
АЛКАНИ. ГАЛОГЕНПОХІДНІ АЛКАНІВ
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 4122; Нарушение авторских прав?; Мы поможем в написании вашей работы!