
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості і добування насичених одноосновних кислот
|
|
|
|
Властивості. Кислоти гомологічного ряду з нормальною будовою від мурашиної до С8Н17СООН за звичайних умов - безбарвні рідини, що мають різкий запах. Вищі члени ряду, починаючи з С9Н19СООН,- тверді речовини. Мурашина, оцтова і пропіонова кислоти добре розчиняються з нею в будь-яких співвідношеннях. Інші рідкі кислоти обмежено розчиняються у воді. Тверді кислоти у воді практично нерозчинні.
Особливості хімічних властивостей карбонових кислот зумовлені сильними взаємним впливом карбонільної С=О і гідроксильної О-Н-груп.
У карбоксильній групі зв¢язок між вуглецем й карбонільним киснем сильно полярний. Проте позитивний заряд на атомі вуглецю частково зменшується в наслідок притягання електронів атома кисню гідроксильної групи. Тому в карбонових кислотах карбонільний вуглець менш схильний до взаємодії з нуклеофільними частинками, ніж в альдегідах і кетонах. З іншого боку, під впливом карбонільної групи підсилюється полярність зв¢язку О-Н за рахунок зміщення електронної густини від кисню до атома вуглецю. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:

Розглянутий характер електронної будови карбоксильної групи зумовлює відносну легкість відщеплення атома водню цієї групи. Тому у карбонових кислот добре виявленні кислотні властивості. У безводному стані і особливо у водних розчинах карбонові кислоти дисоціюють на іони:
СН3 - СН2 - СООН Û СН3 - СН2 - СОО- + Н+.
Кислотний характер розчинів карбонових кислот можна встановити за допомогою індикаторів. Карбонові кислоти є слабкими електролітами, при чому сила карбонових кислот зменшується зі збільшенням молекулярної маси кислоти.
Для насичених одноосновних кислот найбільш характерні реакції, зумовлені кислотними властивостями, а також реакції заміщення гідроксильної групи.
1. Взаємодія з металами. Карбонові кислоти реагують з деякими металами з утворенням солей і водню, наприклад:
2CH3COOH + Mg ® Mg(CH3COO)2 + H2
Ацетат магнію
2. Взаємодія з основними оксидами і основами. Як усі кислоти, карбоксильні сполуки реагують з основними оксидами і основами, наприклад:
2С2Н5СООН + MgO ® Mg(С2Н5СОО)2 + H2O;
С2Н5СООН + KOH ® С2Н5СООK + H2O
з водним розчином аміаку, який виявляє властивості основ, карбонові кислоти також утворюють солі:
С2Н5СООН + NH3 ® С2Н5СООNН4.
3. Взаємодія зі спиртами. Карбонові кислоти реагують зі спиртами при наявності сильних неорганічних кислот. Від молекули кислоти відщеплюється група ОН, від молекули спирту — атом Н, в результаті утворюються складні ефіри:

4. Взаємодія з галогенідами фосфору і сірки. Галогеніди фосфору (РСІ 5, РСІ3) і сірки (SОСl2) взаємодіють з карбоновими кислотами, утворюючи хлорангідриди кислот, наприклад:
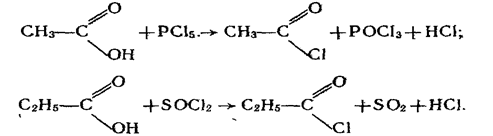
5. Взаємодія з водовідбирними агентами. Під дією сильних водовідбирних речовин, наприклад Р2O5, на карбонові кислоти утворюються ангідриди кислот:
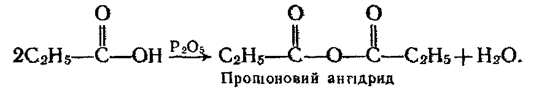
6. Взаємодія з галогенами. Яків альдегідах, хлор і бром можуть заміщувати атом водню біля другого вуглецевого атома з утворенням галогеноза заміщених кислот, наприклад:

7. Відновлення і каталітичне гідрування. Відновлюючи карбонові кислоти, можна добути альдегіди і первинні спирти, наприклад:

Відновлення кислот відбувається дуже важко.
Добування. Основні метода добування карбонових кислот такі.
1. Окислення первинних спиртів і альдегідів. Спирти і альдегіди окислюються досить легко наприклад:

Під час окислення кетонів, вторинних і третинних спиртів у жорстких умовах (сильні окислювачі, нагрівання) відбувається розщеплення вуглецевого ланцюга молекул і утворюється, як правило, суміш карбонових кислот. Наприклад, окислюючи ацетон, можна добути суміш мурашиної і оцтової кислот.
2. Окислення алканів. Суміш нижчих алканів (бутан—октан) окислюється при наявності каталізаторів переважно до оцтової кислоти. Алкани, що містять 9—20 вуглецевих атомів, окислюються до вищих кислот.
3. Гідроліз нітрилів. Нітрили—сполуки типу R— С=N. Під час нагрівання нітрилів з додою, в яку добавлено неорганічні кислоти, утворюються карбонові кислоти, наприклад:

4. Карбонілування алкенів. Кислоти, починаючи з пропіонової, можна добути приєднанням оксиду вуглецю (II) і води до алкенів. Каталізатором реакції є фосфорна кислота, процес відбувається при температурі 300—350°С і тиску 20—30 МПа. Приклад:

ЛЕКЦІЯ №12.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 821; Нарушение авторских прав?; Мы поможем в написании вашей работы!