
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Триатомні спирти, або гліцерини
|
|
|
|
З усіх триатомних спиртів найбільше вивчений і має найважливіше значення найпростіший представник – гліцерин.
Гліцерин. СН2ОНСНОНСН2ОН вперше був відкритий у 1779 p. Шведським хіміком К. Шеєле як продукт гідролізу маслинової олії. Він широко поширений в природі, входить до складу жирів і масел, які являють собою складні ефіри гліцерину та вищих жирних насичених і ненасичених кислот.
Раніше більшу частину гліцерину одержували як побічний продукт у миловарному виробництві під час омилення рослинних і тваринних жирів у присутності каталізаторів (кислот, лугів, оксидів цинку і магнію та ін.):
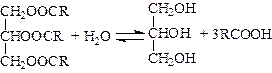 .
.
У зв’язку з необхідністю скорочення витрат харчових жирів для технічних цілей і безперервним збільшенням використання гліцерину великого народногосподарського значення набувають синтетичні методи добування гліцерину.
Вперше синтез гліцерину з пропілену в промисловому масштабі був здійснений у 1947 p. В США за методом американського вченого Вільямса. Метод Вільямса, детально вивчений радянськими дослідниками, складається з чотирьох стадій:
1. Пропілен хлорують при 400 – 500°С:
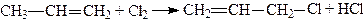 .
.
2. Утворений хлористий аліл омилюють в аліловий спирт розчином гідроксиду натрію або соди при 150 – 160°С і 14 ат.;
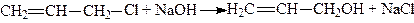 .
.
3. Пропускаючи хлор крізь 4 – 5%-ний водний розчин алілового спирту при 14 – 20°С одержують монохлоргідрини гліцерину:
 .
.
4. Омиленням монохлоргідринів гліцерину добувають гліцерин:
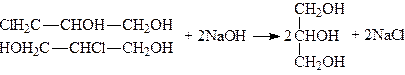 .
.
Гліцерин можна добувати з пропаргілового спирту. Гідруванням пропаргілового спирту можна одержати аліловий спирт. При обережному окисленні алілового спирту перманганатом калію у лужному середовищі утворюється гліцерин:
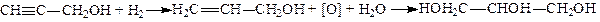
В останні роки розроблено новий спосіб одержання гліцерину без затрати хлору. За цим методом спочатку за допомогою оксигену (у присутності каталізатора оксиду міді (І)) окислюють пропілен при температурі близько 370°С в акролеїн; потім приєднанням перекису гідрогену до акролеїну одержують гліцериновий альдегід; останній при відновленні перетворюється в гліцерин:
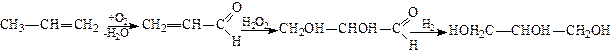
Гліцерин – безбарвна, дуже в’язка і гігроскопічна рідина, солодка на смак, питома маса її 1,26 (при 20°С). Змішується з водою і спиртом, нерозчинний в ефірі, хлороформі та бензолі, легко розчиняє багато органічних і неорганічних сполук. Кипить при 290°С з частковим розкладом, тому його переганяють під вакуумом. Водні розчини гліцерину замерзають лише при сильному охолодженні. Являючись триатомним спиртом, гліцерин утворює три ряди похідних.
При нагріванні гліцерину з оксидами металів утворюються гліцерати, наприклад:
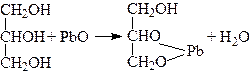 .
.
При взаємодії гліцерину з галогеноводневими кислотами або галогенідами фосфору утворюються галогенгідрини гліцерину, наприклад монохлоргідрини, дихлоргідрини, трихлоргідрини:
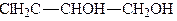
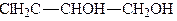
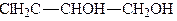
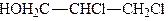
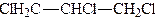 .
.
При взаємодії гліцерину з кислотами, хлорангідридами або ангідридами можуть утворюватися три ряди складних ефірів. З мінеральними кислотами, наприклад з фосфорною, гліцерин утворює складні моноефіри:
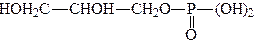 .
.
Повні ефіри утворюються з нітратною кислотою – тринітрогліцерин (нітрогліцерин):
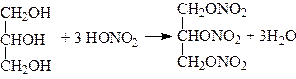 .
.
З органічними кислотами гліцерин утворює гліцериди, наприклад з оцтовою кислотою може утворювати триацетат:
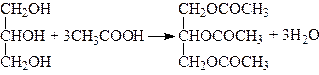 .
.
При нагріванні гліцерину до високої температури, особливо в присутності водовіднімаючих засобів (KHSО4, Н3ВО3, безводний mgsо4), утворюється акролеїн:
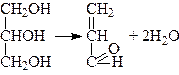 .
.
Вживаючи м’якодіючі окислювачі, можна провести реакцію окислення гліцерину так, що окислиться лише одна спиртова група – первинна або вторинна:
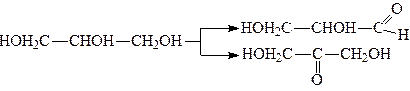 .
.
Помірно концентрована нітратна кислота перетворює гліцерин в гліцеринову кислоту:
 .
.
Окисленням гліцерину сильними окислювачами (перманганатом) у лужному середовищі добувають щавлеву кислоту:
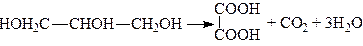 .
.
Хромпіком у присутності сульфатної кислоти гліцерин окислюється кількісно, це використовують для аналізу.
Гліцерин має широке застосування в хімічній, харчовій, текстильній, поліграфічній та інших галузях промисловості. Значна кількість його йде на добування нітрогліцерину, гліфталевих та інших синтетичних смол, туалетного мила, лікарських і косметичних препаратів.
Застосовується як засіб для пом’якшення шкіри, підсолоджування вин, лікерів, лимонадів та інших напоїв, у виготовленні незамерзаючих сумішей для автомобільних радіаторів та авіаційних двигунів, як мастило, робоча рідина в гідравлічних насосах та інших гідравлічних системах і. Т.д.
Нітрогліцерин (правильна назва – гліцеринтринітрат) – повний складний ефір гліцерину та нітратної кислоти. Чистий нітрогліцерин являє собою безбарвну маслянисту рідину. Пара його надзвичайно отруйна. Нітрогліцерин – дуже вибухонебезпечна речовина. Він легко вибухає від удару, струсу, нагрівання та саморозкладу. Нітрогліцерин використовується на виготовлення динаміту і нітрогліцеринових порохів. 1%-ний спиртовий розчин нітрогліцерину застосовується в медицині як судинорозширювальний засіб при стенокардії.
Прості ефіри (естери, етери)
Прості ефіри можна розглядати і як похідні спиртів, у яких гідроген гідроксильної групи заміщений одновалентним вуглеводневим радикалом: R—OH R—O—R і як похідні води, в якій обидва атоми гідрогену заміщені одновалентними вуглеводними радикалами:
Н—О—Н R—O—R.
У залежності від того, чи є в молекулі ефіру однакові або різні вуглеводневі радикали, їх поділяють на прості й змішані ефіри:
| R—O—R | R—O—R' |
| Простий ефір | Змішаний ефір |
Номенклатура та ізомерія. Як правило, назви ефірів виводять від назви радикалів: СН3—О—СН3 – диметиловий (метиловий) ефір; СН3—О—С2Н5 – метилетиловий ефір; C2H5—О—C2H5 – діетиловий (етиловий) ефір.
За женевською номенклатурою прості ефіри розглядаються як вуглеводні, в яких атом гідрогену заміщений алкоксирадикалом: метоксиметан СН3—О—СН3 і т.д. Однак такі назви вживаються рідко.
Прості й змішані ефіри ізомерні спиртам: С2Н5ОН (спирт) СН3—О—СН3 (ефір).
Крім того, ізомерія ефірів може обумовлюватися ще тим, що з оксигеновим атомом можуть бути зв'язані радикали різного складу (метамерія). Наприклад:
С2Н5—О—С2Н5 (діетиловий ефір) СН3—О—С3Н7 (метилпропіловий ефір).
Способи добування. 1. Дія водовіднімаючих засобів на спирти. Найбільш важливим способом добування є дія на спирти водовіднімаючими засобами (сульфатна й фосфатна кислоти, органічні сульфокислоти, безводний хлористий цинк та ін.).
У промисловості ефіри одержують також пропусканням парів спирту при 240 – 260°С над оксидом алюмінію, який є каталізатором:
С2Н5OH + С2Н5OH = C2H5—O—С2Н5 + H2O.
2. Дія галогенопохідних на алкоголяти. Прості й змішані ефіри можуть бути одержані дією галогеналкілів на алкоголяти (синтез Вільямсона):
С3н7ona + С2Н5J = C2H5—O—С3Н7 + naj.
Відповідним підбором реагентів цим шляхом можна добути симетричні і змішані ефіри.
Фізичні властивості. Диметиловий і метилетиловий ефіри при звичайній температурі – гази, більш складні ефіри – легко леткі рідини; починаючи з (С17Н35)2O – ефіри вже тверді тіла. Прості ефіри дуже погано розчиняються у воді і добре – в органічних розчинниках. Нижчі представники киплять при більш низькій температурі, ніж відповідні їм спирти. Це пояснюється тим, що спирти, подібно до води, добре асоційовані внаслідок наявності гідроксильної групи. У той же час ефіри перебувають в мономолекулярному стані через відсутність в них гідроксилу, що обумовлює асоціацію води і спиртів. Питома вага також нижча за питому вагу відповідних спиртів.
Хімічні властивості. Прості ефіри – нейтральні речовини, дуже стійкі в хімічному відношенні. При звичайній температурі луги, більшість кислот, металічний натрій, п'ятихлористий фосфор на них не впливають.
1. Концентрована і особливо димуча сульфатна кислота реагує з простими ефірами, утворюючи складні ефіри і спирти.
2. Концентрована йодистоводнева кислота вже при звичайній температурі розщеплює ефір на спирт і йодистий алкіл:
СН3СН2—O—СН2СН3 + HJ = СН3СH2J + СН3СН2OН.
При нагріванні реакція проходить з утворенням двох молекул галогеналкілу, наприклад:
СН3—СН2—O—СН3 + 2HJ = СН3СН2J+СН3J + Н2O.
3. При звичайній температурі металічний натрій не впливає на прості ефіри, але при нагріванні (П.П. Шоригін) натрій розщеплює прості ефіри з утворенням алкоголяту натрію і натрій-органічної сполуки:
С2Н5—O—С2Н5 + 2Na = с2н5ona +С2Н5Na.
З простих естерів найбільше значення має діетиловий ефір, який часто називають просто ефіром. Цей ефір був добутий ще у 1540 р., алхіміком В. Кордусом дією концентрованої сульфатної кислоти на етанол і названий ним сірчаним ефіром. Етиловий ефір – безбарвна, рухлива, надзвичайно вогненебезпечна рідина зі специфічним запахом, важко розчиняється у воді (у 100 масових частинах води при 20 °С розчиняється 6,5 масових частин ефіру) і сам частково розчиняє воду (~1,2%). Повністю безводний ефір називають абсолютним. З органічними розчинниками діетиловий ефір змішується в будь-яких співвідношеннях.
Діетиловий ефір застосовується у виробництві бездимного пороху, штучного шовку, колодію, в медицині – для наркозу (зараз практично не використовують). Цей ефір використовують також як розчинник при синтезі магнійорганічних сполук.
Відомі також циклічні прості ефіри, прикладом яких є діоксан:
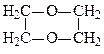 .
.
Прості ефіри при зберіганні на світлі окислюються оксисеном повітря і утворюють вибухонебезпечні гідропероксиди:
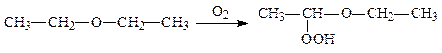
Утворення пероксидних сполук було причиною багатьох нещасних випадків під час перегонки ефіру. Тому перед початком роботи з простим ефіром необхідно перевірити, чи містить даний ефір пероксидні продукти. Для цього пробу ефіру перемішують з розчином калій йодиду. Побуріння розчину свідчить про наявність перекисів, які окислюють калій йодид до вільного йоду. Щоб очистити ефір, його змішують з феррум (ІІ) сульфатом.
ЛЕКЦІЯ №10.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 4655; Нарушение авторских прав?; Мы поможем в написании вашей работы!