
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двоатомні спирти, або гліколі
|
|
|
|
Двоатомні спирти інакше називаються гліколями внаслідок солодкого смаку багатьох представників цього класу (глікос по-грецькому – солодкий).
У залежності від положення гідроксильних груп розрізняють a-гліколі, якщо обидва гідроксили знаходяться біля двох суміжних атомів карбону; b-гліколі, якщо гідроксили розміщені через один атом карбону; g-гліколі, якщо гідроксили розміщені через два атоми карбону, і т.д.
Способи добування. Гліколі можна добувати тами ж способами, що й одноатомні спирти.
1. З дигалогенопохідних вуглеводнів, у яких атоми галогену знаходяться біля різних атомів карбону, дією розчином соди:
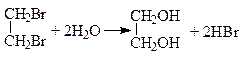 .
.
Сода зв’язує гідроген хлорид, який при цьому утворюється.
2. Гідролізом галогенгідринів (галогенопохідних спиртів):
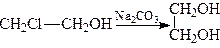 .
.
3. Гідролізом оксидів:
 .
.
4. Відновленням карбонільних сполук. При відновленні ацетону за допомогою амальгами натрію або магнію в присутності води утворюється пінакон (2,3-диметилбутандіол-2,3):
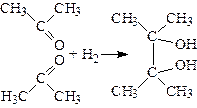 .
.
5. Приєднанням перекису гідрогену до алкенів:
СН3–СН=СН2 + Н2О2 = СН3СНОНСН2ОН.
Фізичні властивості. Нижчі гліколі являють собою в’язкі, добре розчинні у воді рідини, вищі – тверді, важкорозчинні у воді речовини. Питома маса, температури кипіння та плавлення у гліколей значно вищі, ніж у відповідних одноатомних спиртів.
Хімічні властивості. Хімічні властивості гліколей аналогічні властивостям одноатомних спиртів, причому в реакції можуть брати участь одна або обидві гідроксильні групи. Тому гліколі утворюють два ряди похідних – повні та неповні. Однак хімічні властивості гліколей мають деякі особливості, які зв’язані з наявністю двох гідроксилів.
1. Окислення. При дії окислювачів гліколі можуть утворювати значно більше продуктів окислення з тією ж кількістю атомів Карбону, ніж одноатомні спирти. Наприклад, при окисленні етиленгліколю можуть утворитися такі продукти окислення:
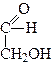
| 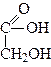
| 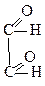
| 
| 
|
| Гліколевий альдегід | Гліколева кислота | Гліоксаль | Гліоксилова кислота | Щавлева кислота |
2. Внутрішньомолекулярне виділення води. g- і d-гліколі легко втрачають молекули води, перетворюючись на циклічні прості ефіри. Наприклад:
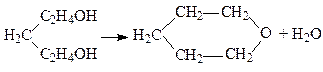
| |
| Пентадіол–1,5 | Оксид пентаметилену |
3. Міжмолекулярне виділення води. Як встановив О.Є. Фаворський, при нагріванні етиленгліколю з невеликою кількістю концентрованої сульфатної кислоти з двох молекул етиленгліколю виділяються дві молекули води і утворюється діоксан:
 .
.
4. Утворення гліколятів. На відміну від одноатомних спиртів гліколі легко вступають в реакції не тільки з лужними металами, але й з лугами і гідроксидами важких металів. З лужними металами, лугами гліколіз утворюють повні і неповні алкоголяти (гліколяти):
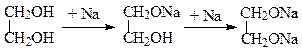
З гідроксидами важких металів, наприклад з гідратом оксиду міді, гліколіз утворюють комплексні гліколяти. При цьому нерозчинний у воді міді (ІІ) гідроксид у гліколіз легко розчиняється:
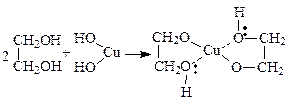 .
.
Мідь у цьому комплексі утворює з атомами Оксигену два ковалентних зв’язки і два – координаційних. Реакція є якісною на двохатомні спирти.
Етиленгліколь (етандіол-1,2) CH2OH–СН2ОН – в’язка безбарвна рідина зі слабким запахом і солодким смаком; температура кипіння 197°С. Змішується у всіх відношеннях з водою, ацетоном і спиртом.
Одержують етиленгліколь у промисловості, головним чином, гідратацією оксиду етилену в рідкій фазі в присутності каталізаторів сульфатної або фосфорної кислот при 50 – 100°С або без каталізаторів під тиском 22 ат. При 190 – 200°С.
Етиленгліколь в останній час набув великого технічного значення. Він використовується для виготовлення антифризів – незамерзаючих рідин, які замінюють воду в радіаторах автомобільних і авіаційних моторів узимку. 60%-ний водний розчин етиленгліколю замерзає тільки при –49°С. Етиленгліколь застосовується у виробництві вибухових речовин, штемпельних фарб, косметичних препаратів і т.д.
Пінакони – двотретинні спирти, у яких обидві гідроксильні групи знаходяться біля суміжних атомів Карбону. Найпростішим пінаконом є 2,3-диметилбутандіол-2,3 пінакон. Добувають його відновленням ацетону. При нагріванні з сульфатною кислотою пінакон втрачає молекули води, і в результаті внутрішньомолекулярного перегрупування утворюється несиметричний кетон – пінаколін:
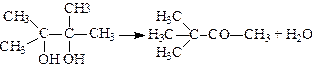 .
.
Такий вид зміни будови карбонового скелета молекул, який полягає в утворенні кетонів з переміщенням одного з радикалів до суміжного атома Карбону при дегідратації a-гліколей, дістав назву пінаколінового перегрупування.
Бутандіол-1,4 СН2ОНСН2СН2СН2ОН – добувають гідруванням бутин-2-діолу-1,4, який одержують за методом Реппе пропусканням ацетилену під тиском 5 ат. Крізь нагрітий водний розчин формальдегіду в присутності мідного каталізатора. Бутандіол-1,4 застосовується для добування пластифікаторів, пластмас, тетрагідрофурану і як замісник гліцерину.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 7603; Нарушение авторских прав?; Мы поможем в написании вашей работы!