
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы, атомы и молекулы
|
|
|
|
Самый распространенный элемент: в земной коре (литосфере) – кислород (46,60 % по массе), в атмосфере – азот (78,09 %), вне Земли – водород (90 %). Самый редкий элемент из существующих в природе – астат (во всей земной коре его всего лишь 0,16 г). Из простых веществ при обычных условиях самый тяжелый металл – иридий, его плотность 22,65 г/см3; чуть‑чуть отстал от иридия осмий (22,61 г/см3). Гирю в виде шара из этих металлов радиусом всего 10 см вы не сможете даже оторвать от пола! Напомним, что плотность ртути – 13,6 г/см3 (это самая тяжелая при обычных условиях жидкость), а свинца – «всего» 11,3 г/см3.
Самый легкий металл – литий (0,534 г/см3), он в 42 раза легче иридия и даже легче бензина! Следующий по плотности металл – натрий почти вдвое тяжелее. Самое тяжелое газообразное простое вещество – радон (плотность 9,73 г/л), а самое легкое – водород (0,09 г/л, этот газ в 108 раз легче радона!). Если рассматривать не только элементы, то на роль самого тяжелого при комнатной температуре газа будет, вероятно, претендовать бесцветный фторид вольфрама(VI) WF6 (12,9 г/л при 20 °С), а при температуре выше 50 °С – легколетучий UF6. Если WF6 охладить ниже 17 °С, он перейдет в очень тяжелую жидкость с плотностью 3,44 г/см3; ведерко объемом 10 л с такой жидкостью будет весить более 34 кг! Еще тяжелее водный раствор смеси солей таллия муравьиной и малоновой кислот (формиата и малоната) в соотношении 1: 1 по массе. При растворении этих солей в указанной пропорции в минимальном количестве воды образуется раствор с уникальной плотностью 4,324 кг/л при 20 °С, а горячий раствор (при 95 °С) можно довести до плотности 5,0 кг/л. В таком растворе плавают кварц, корунд и даже гранит. А самая легкая при комнатной температуре и атмосферном давлении жидкость – изопентан (СН3)2СНСН2СН3 (0,62 г/см3). Жидкий бутан при температуре кипения (–0,5 °С) имеет плотность 0,58 г/см3, а жидкий водород при температуре кипения (–252,8 °С) – 0,071 г/см3; такая жидкость в 10‑литровом ведре будет весить всего 710 г!
Самый твердый металл – технический хром (хром высокой степени чистоты не такой твердый), а самый мягкий – цезий. Наибольшая теплопроводность – у серебра, наименьшая – у ртути (почти в 50 раз меньше, чем у серебра); наибольшая электропроводность – тоже у серебра (следующими в порядке уменьшения электропроводности идут медь, золото и алюминий), а наименьшая – у германия (почти в 60 000 раз меньше, чем у серебра!). Самый высокий потенциал ионизации – у гелия‑4 (24,59 эВ).
Такую энергию имеют фотоны в дальней (вакуумной) ультрафиолетовой области с длиной волны 50 нм. Легче всего оторвать электрон от атома цезия – всего 3,89 эВ; атомы цезия могут подвергаться ионизации уже под действием солнечного света с длиной волны менее 320 нм.
Самая большая критическая масса у урана‑235 – 48 кг (но так как уран очень тяжелый, радиус уранового шара в такой атомной бомбе невелик – всего около 9 см). Наименьшая – у калифорния‑251 (всего 10 г).
Наиболее ковкий металл – золото: из 1 г можно вытянуть проволоку длиной 2,4 км; такая золотая проволочка в 10 раз тоньше человеческого волоса. Самый тугоплавкий металл – вольфрам, он плавится при 3380 °C. При более высокой температуре (4215 °С) плавится лишь твердый раствор карбидов гафния и тантала.
Самый большой атом вовсе не урановый (№ 92 в периодической системе) или атом одного из недавно открытых элементов конца периодической системы, например дармштадтия (№ 110) или рентгения (№ 111). Действительно, радиус атома урана – самого тяжелого элемента, который Д. И. Менделеев разместил в конце своей знаменитой таблицы, равен 154 пм, тогда как диаметр еще 16 атомов превышает это значение. Самый большой из них – атом цезия (272 пм), второе «призовое место» занимает рубидий (250 пм), третье – калий (235 пм). Четвертое и пятое места заняли соответственно атомы бария (224 пм) и стронция (215 пм). Зато никаких неожиданностей при определении самого маленького атома; конечно, это атом первого элемента в периодической системе, атом водорода (37 пм).
По‑видимому, здесь нужны комментарии. Сначала о единицах измерения. Пикометр (от исп. pico – «малая величина») – первая составная часть наименований некоторых физических единиц, означающая одну триллионную (10–12) долю исходной единицы. Например, 1 пФ (пикофарада) = 10–12 фарады, 1 пм = 10–12 м = 1000 нм (нанометров; от греч. nannos – «карлик»; нанометр – миллиардная часть метра).
Теперь о самих значениях радиусов. Не следует думать, что для их измерения нужны какие‑то изощренные методы анализа. Атомы можно рассматривать как шары. Тогда их радиус легко рассчитать, зная постоянную Авогадро, массу моля элемента, его плотность и строение кристаллической решетки. Последнее необходимо для внесения поправки на «пустой объем» между шариками‑атомами. Так, многие металлы имеют плотнейшую шаровую упаковку. При этом каждый атом‑шар будет касаться 12 соседних: шесть из них разместятся вокруг него в одной плоскости и еще по три – сверху и снизу, в образовавшихся «ямках» (это легко увидеть с помощью шариков из пластилина). Чисто геометрически можно показать, что если шары уложить таким способом, то они займут 74,05 % всего объема (остальное приходится на пустоты между шарами).
Рассмотрим теперь атомы меди. Из справочника «Свойства неорганических соединений» следует, что радиус этих атомов равен 0,128 нм = 128 пм. Как получено это значение? Возьмем 1 моль (6,022 · 1023 атомов) меди. Его масса равна 63,55 г. Плотность меди (из того же справочника) равна 8,96 г/см3, поэтому 1 моль занимает объем 63,55/8,96 = 7,093 см3. Из этого объема на сами атомы приходится 0,7405 · 7,093 = 5,252 см3, а один атом имеет объем V = 5,252/6,022 · 1023 = 0,8721 · 10–23 см3. Как известно, объем шара V = 4π r 3/3, r = √3 V /4π= 1,28 · 10–8 см, что совпадает с данными справочника.
Почему же самые тяжелые атомы не самые большие? Здесь конкурируют два фактора: увеличение общего числа электронов (именно электронная оболочка, а не крошечное ядро, определяет размер атома) и усиление притяжения электронов к ядру. Так, в ряду лантаноидов и актиноидов с ростом атомного номера наблюдается не увеличение, а уменьшение радиуса атомов, несмотря на увеличение числа электронов в них (этот факт имеет существенное значение для химии этих элементов). Происходит это потому, что последовательное добавление f ‑электронов не может оказать серьезную конкуренцию действию возрастающего заряда ядра на внешние s – и p ‑электроны: они становятся чуть ближе к ядру. В результате атом последнего лантаноида – лютеция на 7 % меньше атома лантана. Теперь не покажется удивительным, что самый большой размер атома у цезия с его отдаленным от ядра s ‑электроном на внешней оболочке (атом франция должен иметь еще бо́льший радиус, но этот элемент нестабилен и принципиально не может быть получен в виде компактного металла, потому размер его атомов имеет лишь теоретический интерес).
До сих пор речь шла о невозбужденных атомах, поскольку при поглощении энергии излучения внешний электрон может удаляться от ядра все дальше и дальше, занимая орбиталь со все бо́льшим номером. Поэтому, например, атом водорода теоретически может иметь любые размеры. А практически? В 1991 г. в самом известном в мире журнале, посвященном химическому образованию – Journal of Chemical Education (он издается в США), была опубликована статья Д. Б. Кларка. В ней говорилось, что в межзвездных облаках были обнаружены по их спектрам атомы водорода диаметром 0,4 мм (они зафиксированы по спектральному переходу с 253‑й на 252‑ю орбиталь). Объекты таких размеров вполне можно увидеть невооруженным глазом! Однако Кларк ошибся – он завысил все размеры ровно в 100 раз (об этом сообщил тот же журнал год спустя; возможно, ошибка была связана с неправильным переводом нано– или пикометров в миллиметры). Значит, обнаруженные атомы водорода имеют диаметр «всего лишь» 0,004 мм, и такие атомы, даже если бы они были «твердыми», невооруженным глазом увидеть нельзя – только в микроскоп. Конечно, по атомным меркам и 0,004 мм – величина огромная, она в миллион раз больше диаметра невозбужденного атома водорода. Обсуждаемый же Кларком гипотетический атом водорода «размером с одноцентовую монетку» (ее диаметр 9 мм) с учетом исправлений должен соответствовать переходу с 13044‑й на 13043‑ю орбиталь, что отвечает частоте излучения 2,96 килогерц или длине волны 100 км. Такие спектральные переходы, даже если бы они происходили, невозможно было бы обнаружить никаким прибором (даже радиотелескопы фиксируют в тысячи раз меньшие длины волн).

Надпись IBM атомами ксенона
Если же говорить о «вооруженном» глазе, то отдельные атомы можно не только «увидеть» – ими можно даже что‑нибудь написать. Например, всемирно известное название компьютерной фирмы IBM, как это сделали ученые, используя сканирующий туннельный микроскоп и 35 самых настоящих атомов ксенона, выстроенных в нужные микроскопические буквы на поверхности никелевого кристалла. Другой «атомный» рекорд связан с временем жизни радиоактивных нуклидов (напомним, что нуклидом называется совокупность атомов с определенным числом протонов и нейтронов в Надпись IBM ядре; нуклиды одного и того же атомами ксенона элемента называются изотопами; сейчас известно примерно 2400 нуклидов 114 химических элементов, большинство из которых радиоактивны). Судя по справочнику «Физические величины», самый долгоживущий – теллур‑128, который и радиоактивным‑то назвать трудно: период полураспада этого нуклида (его в природном теллуре 31,7 %) превышает 8 септиллионов (8 · 1024) лет! Для сравнения – нашей Вселенной по оценкам «всего» 10 млрд (1010) лет.
А какие атомы живут меньше всех? В справочнике «Физические величины» для самого короткоживущего изотопа – франция (215Fr) приводится значение 9 · 10–8 с (меньше одной десятимиллионной доли секунды). Следует воздать должное исследователям, сумевшим измерить эту величину. А вот в «Справочнике нуклидов» для самого легкого из известных изотопов кислорода, 12О, приводится удивительное значение: 1,0 · 10–21 с (одна секстиллионная секунды)! Удивительно оно потому, что даже свет, скорость которого составляет 3 · 108 м/с за это время прошел бы всего 3 · 10–13 м = 0,3 пм, что намного меньше размеров атомов и сопоставимо с размером атомного ядра. Значит, за это время частица, которая должна вылететь из ядра при его распаде и скорость которой намного меньше световой, не успеет его даже покинуть. Было бы интересно узнать, как такое ядро может образоваться и как получили такое значение для его времени жизни.
Атомы соединяются между собой химическими связями. Эти связи могут быть сильными и слабыми, короткими и длинными. В результате образуются молекулы, а также ионные, атомные и металлические кристаллы. Между молекулами тоже действуют химические связи. Какая же связь самая прочная? Если рассматривать только одинарные связи, то самой прочной будет связь Т–Т в молекуле тяжелого водорода – трития Т2 (447,2 кДж/моль); далее следуют связи с атомами дейтерия: D–T (445,5 кДж/моль), D–D (443,6 кДж/моль) и H–D (439,6 кДж/моль). Самая слабая (хотя и не намного) в «водородных молекулах» – связь Н–Н (436,2 кДж/моль).
В случае кратных связей одна из самых прочных – тройная связь N≡N между двумя атомами азота (945,3 кДж/моль). Известны и более прочные связи. Так, прочность четверной связи между атомами хрома в дианионе [Cl3(H2O)Cr == Cr(H2O)Cl3]2– оценивается в 1200 кДж/моль! Самая прочная связь между атомами разных элементов в молекуле угарного газа СО (1070,3 кДж/моль). Вероятно, самая слабая ковалентная связь между атомами азота в молекуле азотистого ангидрида N2O3 (40,6 кДж/моль); она почти в 25 раз слабее связи между теми же атомами в молекуле N2. Недаром азотистый ангидрид (в чистом виде его можно получить в виде голубого порошка при пропускании электрических искр через жидкий воздух при температуре ниже –190 °С) начинает разлагаться на NO и NO2 уже ниже 0 °С. При этом образуется раствор зеленого цвета (смешение синего цвета N2O3 и желтобурого цвета NO2).
Слабыми (по сравнению с ковалентными) традиционно считаются водородные связи. Однако водородная связь между HF и ионом F– (150 кДж/моль) значительно прочнее ковалентных связей в оксидах азота N2O3 и N2O4 (40,6 и 56,9 кДж/моль). Но, конечно, самые слабые связи (вандерваальсовы) существуют между неполярными молекулами и между атомами благородных газов. В 1993 г. было доказано существование молекул Не2, в которых энергия связи между атомами гелия равна всего лишь 0,008 Дж/ /моль. Это в десятки миллионов раз меньше, чем в случае типичных ковалентных связей! Атомы гелия в этой молекуле находятся в среднем на расстоянии 6,2 нм друг от друга, тогда как длина типичной химической связи находится в пределах 0,1–0,3 нм. Это общая закономерность: обычно чем связь слабее, тем она длиннее, и наоборот. И еще одна очевидная закономерность: чем больше атомы, тем больше расстояние между их центрами в молекуле. Так, в полиядерных комплексных соединениях длина связи между атомами рения достигает 0,309 нм, осмия – 0,315 нм, палладия – 0,433 нм.
Конечно, «молекулы» типа Не2 могут существовать лишь при исключительно низких температурах, порядка 0,0001 К, иначе тепловое движение разрушает такие непрочные структуры. При дальнейшем понижении температуры возможно образование еще более слабых и длинных связей. Так, группа французских физиков сообщила, что при температуре 10 мкК (0,00001 К) они получили двухатомные молекулы гелия размером от 8 до 60 нм, что уже соизмеримо с размерами вирусов!
Самая короткая одинарная связь между атомами водорода и дейтерия в молекуле H–D (0,074166 нм; обратите внимание на точность измерения!). Чуть длиннее связи в молекулах D2 и Н2. Самая короткая связь между атомами кислорода в молекуле FО– – ОF (0,1217 нм), а самая длинная – в трехчленном цикле с двумя атомами кислорода, дифтордиоксиране CO2F2 (0,1578 нм). Очень сильно отличаются самая короткая и самая длинная связь азот – азот: 0,10976 нм в N2 и 0,218 нм в димере N2O2.
Для органической химии очень важны связи углерод – углерод. В среднем энергия связи С–С составляет 300–400 кДж/моль; например, в молекуле этана 368,2 кДж/моль. Самая же прочная связь С–С (600 кДж/моль) в молекуле дициана NC–CN, а самая слабая (50,2 кДж/моль) между двумя трифенилметильными радикалами в молекуле гексафенилэтана (С6Н5)3С–С(С6Н5)3. При комнатной температуре такая молекула существовать не может, и в этих условиях рекомбинация двух трифенилметильных радикалов (в одном из них неспаренный электрон локализуется на концевом атоме углерода бензольного кольца) приводит к другой структуре – хиноидной, в которой одно из колец перестает быть ароматическим:
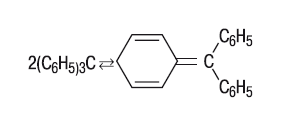
Равновесие между трифенилметильными радикалами и их стабильным димером
Средние, а также рекордные длины связей С–С (нм) приведены в таблице (цифры в скобках соответствуют номеру структуры на рисунке): 
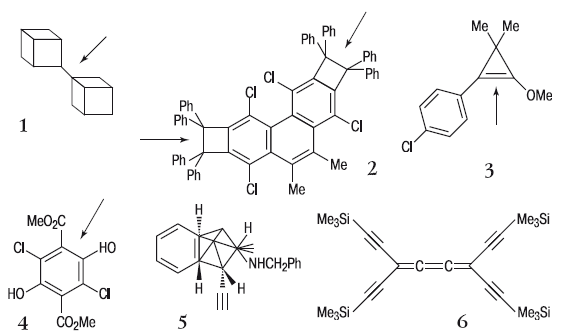
Структуры 1–6
Исключительно сильно могут меняться и углы между связями углерод – углерод. Еще в 1885 г. выдающийся немецкий химикорганик Адольф Иоганн Фридрих Вильгельм фон Байер создал теорию напряжения в циклических молекулах. С тех пор химики синтезировали множество соединений, которые когда‑то считались принципиально невозможными, в том числе из‑за сильного искажения углов между связями. Так, в тетраэдрически связанном атоме углерода, например в молекуле метана СН4, углы между связями должны быть равны 109,4°. Отклонения обычно невелики, в пределах 109–113°. А каковы рекорды? Минимальное значение угла между связями С–С–С (50,7°) зафиксировано в производном циклопропена (3), а максимальное (127,6°) – в бариевой соли спиро[3.3]гептандикарбоновой кислоты (7); это угол между двумя четырехчленными циклами, соединенными вершинами. В случае двойной связи С=С угол у одного из этих атомов углерода равен обычно 116–122°. Таков, например, угол Н–С–Н в молекуле этилена Н2С=СН2. Но и здесь химики синтезировали необычные молекулы. Так, в соединении (3) угол при двойной связи равен лишь 61,9°, а в 1,2‑дигидроциклобута[а]циклопропа[с]бензоле (8) – 176,9°! То есть угол С–С–С у атома углерода, принадлежащего одновременно трех– и шестичленному циклам, почти не отличается от 180°, и эти три атома лежат фактически на одной прямой, хотя два из них связаны двойной связью. Факт удивительный. Не менее удивительно, что авторы статьи – семь работающих в Германии химиков – сумели получить хорошо оформленные кристаллы этого вещества (а оно плавится при температуре –12 °С), чтобы изучить их структуру рентгенографическим методом.
Наконец, в ацетиленовых соединениях угол при тройной связи должен быть равен 180° (линейная молекула), однако в производном тиациклогептина (9) этот угол сильно искажается, уменьшаясь до 145,8°.
Двойные связи С=С могут не только растягиваться и сжиматься, но и скручиваться – сильнее всего в соединениях (10) и (11). Так, в молекуле (10) двугранный угол, образованный циклическими структурами, равен 49,7°. Именно эти циклы с объемистыми заместителями, которые отталкиваются друг от друга, и приводят к скручиванию двойной связи. В соединении же (11) скручивание связи (двугранный угол 49,0°) происходит из‑за образования циклической структуры.

Структуры 7–11
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 929; Нарушение авторских прав?; Мы поможем в написании вашей работы!